- elemeket
- absztrakt
- bevezetés
- Beteg és módszerek
- A betegek nyilvántartása és mintavétel
- Tanulmány és szekvenciaelemzés
- Fehérje expressziós vizsgálat
- Taqman példányszám-teszt
- az eredmény
- Proband medvék mutáció GPD1
- A GPD1 probloinformációja probandában és apjában
- GPD1 fehérjehiány egy proband májszövet mintában
- vita
elemeket
- A betegségek genetikája
- Májbetegség
- Anyagcserezavarok
- mutációk
absztrakt
A klinikopatológiai és laboratóriumi eredmények, köztük a súlyos hepatomegalia, a steatosis és a gyermekkori markáns hipertrigliceridémia, rendkívül ritka. Olyan gyermeket írunk le, akinek a fenti megállapításai vannak, és a kiterjedt diagnosztikai vizsgálatok ellenére sem azonosítottak okot. A teljes exoma szekvenálást a beteg és a szülő DNS-en végeztük. Mutációkat azonosítottak a glicerin-3-foszfát-dehidrogenázt kódoló GPD1-ben, amely katalizálja a dihidroxi-aceton-foszfát és a NADH reverzibilis redox-reakcióját glicerin-3-foszfáttal (G3P) és NAD + -val. Proband örökölte az apától a GPD1 törlést, amelyet a másolatszám-elemzés és a missense változása határoz meg. (R229Q) az anyától. A GPD1 fehérje nem volt jelen a páciens májbiopsziájában Western blot alkalmazásával. A karnitin-palmitoil-transzferázok, a CPT1 és a CPT2 alacsony normális aktivitása jelen volt a páciens bőrfibroblasztjaiban, az ezeket a fehérjéket kódoló gének mutációi nem voltak. Ez az első jelentés egy vegyület GPD1-ben lévő heterozigóta mutációiról, amelyek GPD1 fehérjehiányhoz és csökkent CPT1 és CPT2 aktivitáshoz kapcsolódnak.
A GPD1 (MIM 138420) a citoplazmatikus NAD-függő glicerin-3-foszfát-dehidrogenáz 1-et (GPD1) kódolja, egy 349 aminosav fehérjét, amelynek mérete 37,5 kD, és amely katalizálja a dihidroxi-aceton-foszfát (DHAP) és a NADH reverzibilis redoxreakcióját glicerin-3-ként -foszfát.) és NAD +. Az 1, 2 GPD1 a mitokondriális enzimmel együtt a GPD2 szintén fontos szerepet játszik a redukáló ekvivalensek citoszolból a mitokondriumba történő transzportjában. 2 A közelmúltban a p.Ile119fsX94 kódolását valószínűsítően a GPD1 homozigóta splice mutációját, a 361-1G> C-t azonosították négy nagymértékben szövetséges izraeli arab család 10 családtagjában, akiknél korai kezdetű hepatomegalia, máj steatosis és hipertrigliceridémia mutatkozik. . 2
A monogén hipertrigliceridémiát a lipoprotein lipáz (LPL), az apolipoprotein C-II (APOC2), a HDL-kötő fehérjével rögzített glikozil-foszfatidil-inozitol (GPIHBP1), az apoA-V (APOA51) és az 1-es faktor (LMOurF1) szőnyeg mutációi okozzák. 2, 3, 4 A máj steatosis mint monogén betegség a korai gyermekkorban rendkívül ritka, és Chanarin-Dorfman-szindrómában írták le 5 (ABHD5) mutációt tartalmazó abhidroláz domén és mitokondriális zsírsav-oxidáció hibái, beleértve a CPT1A, CPT2 és nagyon nagyon acil hosszú láncú CoA dehidrogenáz (ACADVL). 5, 6, 7 Ezeknek a betegeknek gyakran más jellemzői vannak, beleértve a hipoglikémiát, az encephalopathiát és a kardiomyopathiát, a myopathiát és a májelégtelenséget. A mély hipertrigliceridémia és a súlyos hepatomegalia kombinációja a korai gyermekkorban rendkívül ritka.
Itt egy kaukázusi beteget írunk le, akinek súlyos hepatomegalia, zsírmáj és súlyos hipertrigliceridémia van, és a vegyület heterozigóta mutációját hordozza GPD1-ben (MIM 138420). Ez az első olyan GPD1 mutáció, amelyet az izraeli arab lakosságon kívül azonosítottak. Megmutatjuk továbbá, hogy a GPD1 fehérje hiányzik a beteg májszövetéből. A GPD2 hiányában nem következett be kompenzációs növekedés a GPD2 szintben. Ezenkívül bár a CPT1A és CPT2 karnitin-palmitoil-transzferázok aktivitása csökkent a beteg fibroblasztjaiban, ezekben a génekben nem mutattak mutációt, és a májszövet-mintájában a CPT1A mennyisége nem változott.
Beteg és módszerek
A betegek nyilvántartása és mintavétel
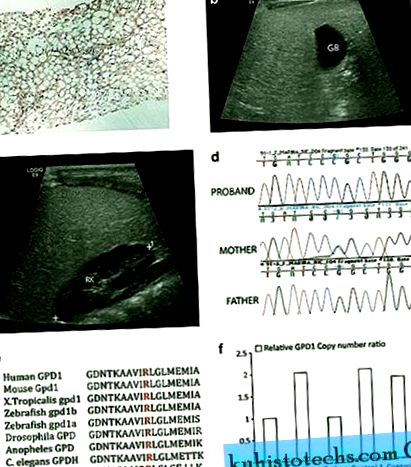
Radiopatológiai és genetikai eredmények GPD1 mutációval rendelkező probandumban . a ) Májbiopszia: a máj parenchyma makro- és mikrovezikuláris zsírváltozásokat mutat a hematoxilin és az eozin (H&E) festésén, nagyítás × 10. b a c ) Az ultrahang finom szemcsés mintázattal demonstrálja a máj diffúz hiperechogenitását. Összehasonlításképpen, epehólyag (GB) ( b ) és a jobb vese parenchima (RK) ( c ) hipoehoikusak. d ) A PCR genomiális termékek DNS-szekvencia-elemzése három GPD1 c.686G> C genotípust szemléltet egy homozigóta probandummal rendelkező családban, egy heterozigóta anya és egy WT apa esetében. e ) A megváltozott arginin maradék (piros) evolúciós szempontból jól konzerválódik gerincesekben és alacsonyabb rendű organizmusokban, beleértve az élesztőt is, a GPD1 és GPD1L fehérjékben. ( f ) A GPD1 expresszió relatív szintje egy kópiaszám assay alkalmazásával feltárta, hogy az apa és a proband GPD1 haploinergia volt az anyához és két kontrollhoz képest.
Teljes méretű kép
Probandát (0091-01) és szüleit (0091-02 és 0091-03) egy IRB által jóváhagyott vizsgálatba vonták be, amelyet a Gene Discovery Core készített a Manton Orphan Disease Research Centerben, miközben kórházba kerültek a bostoni Gyermekkórházban (BCH). ).) Vérmintákat vettünk és dolgoztunk fel DNS kivonásra a BCH-ban található Research Connection Biobank Core segítségével. A diagnosztikus májbiopsziából megmaradt szövetet további molekuláris elemzésekhez vettük.
Tanulmány és szekvenciaelemzés
A proband és mindkét biológiai szülő DNS-ét teljes exomszekvenálásra (WES) küldték az Axeq Technologies-hoz, Rockville, MD, USA. A mintákat Illumina szekvenáló könyvtárként készítettük és exom szekvenciákra dúsítottuk az Illumina Exome Enrichment protokoll segítségével. A rögzített könyvtárakat az Illumina HiSeq 2000 Sequencers segítségével szekvenáltuk. A leolvasásokat a Burrows-Wheeler Alignment (0.5.8 verzió) segítségével humán UCSC hg19 genomkészletre térképeztük fel. Az egy nukleotid polimorfizmusokat (SNP) és a kis inszerciókat/deléciókat SAMtools-nak neveztük (0.1.7 verzió). A variánsokat vagy SNP-ket az NHLBI exome variáns kiszolgálóval (//evs.gs.washington.edu/EVS/) és a dbSNP Build 137 adatbázisok segítségével szűrtük.
PCR-t hajtottunk végre a jelölt gén (GPD1) amplifikálása céljából, az alkalmazott referenciaszekvencia GPD1 volt; NG_032168.1, NM_005276.3. A GPD1-ben azonosított variánsokat beküldtük a Leiden Open Variant Database (LOVD) //databases.lovd.nl/shared/genes/GPD1.
A következő primereket használtuk: GPD1_1F: AGGAGGGGTCTTTTCTCAC és GPD1_1R: ATCAGGTCAGCAACACCACA, és az így kapott amplifikált DNS-t Sanger Sequencing-be küldtük. Az eredményeket a Sequencer 5.0 szoftverrel elemeztük, és összehasonlítottuk a vad típusú (WT) gén szekvenciájával. A primereket úgy terveztük, hogy a GPD1-vel szomszédos különböző SNP-ket szekvenciázzák. SNP tartalmazza: rs836180, rs200359712, rs201128732, rs2640533, rs147189770, rs10875996, rs4898546, rs7139363, rs836170, rs836171, rs113783111, rs836177, rs10783334, rs7964522, rs112386170, rs7964698, rs10735822, rs71464996, rs71441320, rs55639096 és rs12229758.
Fehérje expressziós vizsgálat
Western-blotot alkalmaztunk a GPD1, GPD2 és CPT1A fehérjeszintek mérésére a betegtől kapható májszövet-mintákban és egy kontrollhoz az életkorhoz képest. A szövetet az elemzésig -80 ° C-on tároltuk. Az átvitt fehérjéket GPD1 (HPA044620, hígítás 1: 200, Sigma-Aldrich, St. Louis, MO, USA), GPD2 (Ag11036, hígítás 1: 2000, Proteintech, Chicago, IL, USA), CPT1A ( (Ag7202, 1: 500 hígítás, Proteintech, Chicago, IL, USA) és GAPDH (FL-335 hígítás, 1: 1000 hígítás, Santa Cruz Biotechnology, Santa Cruz, Kalifornia, USA) kontrollként és fokozott kemilumineszcencia segítségével láthatóvá. GAPDH esetén az 1. kötet 4.2.1 (Bio-Rad Laboratories, Inc., Hercules, CA, USA) alkalmazásával a 440-es Image Station-en (Kodak DS; Eastman Kodak Co., Rochester, NY, USA).
Taqman példányszám-teszt
A Taqman kópiaszámlálási vizsgálatot (Life Technologies, Woburn, MA, USA) próbák, szülők és két kontroll DNS-jén végeztük. A GPD1 szondái (Hs00911535_cn, FAM jelzéssel) és a hivatkozási példányszám (4403326, RNase P (RPPH1) VIC jelöléssel) kereskedelemben kaphatók. A tesztet kétszer megismételtük, és három példányban hajtottuk végre. Húsz nanogrammot (1 μl) DNS-t használtunk lyukanként, 12 μl Taqman Universal PCR master keverékkel (Applied Biosystems, Woburn, MA, USA) és 1 μl mindegyik specifikus próbával (cél és kontroll). Az eredmények értelmezéséhez az Applied Biosystems 7300 valós idejű PCR rendszerét használtuk a PCR szoftver és a Sequence Detection v1.4 végrehajtásához. Összehasonlítottuk az amplifikációs diagramokon alapuló DNS-amplifikációt, és átlag ciklusküszöböt (Ct) kaptunk. A kontrollra normalizált cél- és referenciagének kópiaszámának számszerinti változását relatív mennyiség = 2 - A Ct alkalmazásával számítottuk ki. .
az eredmény
Proband hordozza a GPD1 mutációt
A WES-t a trió DNS-mintáin (biológiai szülők és proband) végeztük. Proband homozigóta c.686G> C mutációt hordoz a GPD1 génben, amelyről úgy gondolják, hogy változást okoz a p (R229P) aminosavakban. A Sanger-szekvencia megerősítette a mutációt (1d. Ábra), ugyanakkor az ontariói kutatócsoport függetlenül megszerezte a jelölt génelemzést, és ugyanazt az eredményt kapta (személyes kommunikáció Robert Hegele részéről). Ez a maradék evolúciósan konzerválódott (1e. Ábra), és a mutáció egyik nyilvánosan elérhető SNP adatbázisban sem volt jelen, míg a c.686G> A-t potenciálisan p (P 1 volt, ami összhangban van egy valószínűleg károsító mutációval, és a SIFT 9 elemzése során kiderült, hogy ezt a változást nem lehet tolerálni. Érdekes, hogy bár az anyának heterozigóta mutációja volt, az apa látszólag homozigóta volt a WT allélra nézve. Feltételeztük, hogy az apának lehet egy deléciója ugyanabban a lokuszban, amely örökölte a probandot, vagy az uniparentalis diszomiát mutathatja ki az anya alléljára.
A GPD1 probloinformációja probandában és apjában
Taqman kópiaszám-tesztet hajtottunk végre trióval és két kontroll DNS-mintával annak értékelésére, hogy az apa és a proband haploinerg-e a GPD1-en. A Taqman Hs00911535_cn próba tervezéséhez használt szekvencia szál a GPD1 mutáns lókuszt c.686-ban tartalmazta (Chr 12: g. 50, 501, 423). Az RPPH1 4403326 szondáját használtuk referenciaként. A GPD1 törlését figyeltük meg a probandumban, és az apát egyetlen példány jelenléte jelezte az anyában jelenlévő két példányhoz és két kontrollhoz képest (1f. Ábra). Arra gyanakszunk, hogy a törlés> 1,85 kb, mint egy másik GPD1 lokuszban (rs836180, Chr 12: g. 50, 503, 269), az apa látszólag homozigóta volt az SNP-vel szemben, míg a proband és az anya egyaránt homozigóta volt a WT-vel szemben allél. Annak értékelésére, hogy a deléció tartalmazta-e a GPD1 szomszédságában lévő (5 'és 3') géneket, számos ismert SNP-t genotipizáltunk, amelyek megtalálhatók a SMARD1 és a COX14 génekben. Ezen SNP-k közül sok informatív volt, és nem voltak bizonyítékok törlésükre. A genomi koordináták elhelyezkedése alapján feltételezzük, hogy a deléció kevesebb, mint 28,7 kb. Összefoglalva, a proband heterozigóta két GPD1 mutáció esetében, amelyek az apa törlését és az anya késését hordozzák.
GPD1 fehérjehiány egy proband májszövet mintában
Ezen mutációk hatásainak értékeléséhez proband májbiopsziás mintákat, valamint életkor- és nemkontrollt nyertünk a patológiai osztályról. A GPD1 antitestet használtuk a GPD1 fehérje tesztelésére. A két GPD1 izoformának megfelelő kontrollban két sávot azonosítottunk 37,5 kD (1. izoform) és 35 kD (2. izoform) molekulatömeggel (2. ábra). Érdekes módon az 1. izoform nagyon expresszálódott a kontrollban, de hiányzott a páciensből. Összehasonlításképpen, a 2. izoformot kis mennyiségben fejeztük ki a kontroll mintákban, míg a páciensnél kissé megnőtt. Arra gyanakszunk, hogy az 1. izoform esetében a c.686G> A missense mutáció hatással lehet a splicingre, aberráns transzkripciót hozva létre, amely nonszensz által közvetített lebomláson megy keresztül. Ezenkívül a 2. izoform páciensnél tapasztalt enyhe növekedése másodlagos lehet az 1. izoform hiányával szemben.
Western blot elemzés egy máj biopsziás mintáján egy probandtól és az életkorhoz hasonló kontrollról. A GPD1 fehérje hiányzik a probandumból, bár hasonló mennyiségű GPD2 és CPT1A volt jelen a probandban és a kontrollban.
Teljes méretű kép
A mitokondriális izoform GPD2 szintjét összehasonlítva meghatároztuk, hogy változott-e a GPD1 hiányra reagálva. A GPD2-t specifikus antitest alkalmazásával teszteltük, és a proband nem mutatott változást a GPD2 szintekben.
A CPT1 és CPT2 enzimek aktivitása csökkent volt a tenyésztett bőr fibroblasztjaiban a probandtól, de mindkét gén szekvenálása nem azonosított patogén mutációt. Western-blot segítségével teszteltük a májban a CPT1 A izoformát, a CPT1 A-t, és nem találtunk szignifikáns különbséget a beteg és a kontroll között.
vita
Először számolunk be egy olyan páciensről, aki két heterozigóta GPD1 mutációt, deléciót és késleltetési változást örökölt. Vizsgálataink meggyőzően mutatják, hogy ez a két mutáció GPD1 hiányhoz vezetett. Kora gyermekkorától kezdve a beteg FTT-vel, hányással, súlyos hepatomegaliaval és hipertrigliceridémiával rendelkezett. A klinikai eredmények nagyon hasonlóak voltak négy izraeli arab család 10 olyan személyéhez, akiknél a homozigóta alapmutáció c.361-1G> C volt GPD1-ben, hányást, FTT-t, megnagyobbodott májat és éhomi hipertrigliceridémiát tapasztaltak (TG 258-6244 mg)./dl). 2
A GPD1 a NAD-függő GPD család tagja. Nagy szerepet játszik a lipid bioszintézisében azáltal, hogy a DHAP-ot G3P-vé alakítja, amelyet viszont defoszforileznek glicerinné, majd acilezés zsírsavakkal acil-glicerin-fajok képződéséhez. A DHAP, a glikolízis köztiterméke, a GPD1 hiány miatt nem alakulhat át G3P-vé, ami a DHAP relatív feleslegét és a G3P csökkenését okozza. A GPD1 hiány egérmodelljében a DHAP koncentrációk szignifikánsan magasabbak és a G3P alacsonyabbak voltak a máj, izom és vese WT egerek szintjéhez képest. Betegünk zsírmájának mechanizmusa a felesleges DHAP acilezésének tudható be. Az acil-DHAP útvonalat már leírták, ahol a DHAP először acilezhető, majd redukálható 1-acil-sn-G3P-re. 11, 12 Ismert, hogy az acil-DHAP útvonal fontos szerepet játszik az egerek májának glicerolipidjeinek szintézisében. 12.
A CPT1 és a CPT2 aktivitása alacsony volt a páciens fibroblasztjaiban, de a CPT1A és CPT2 génekben nem mutattak ki mutációt. Továbbá nem csökkent a CPT1A fehérje mennyisége a májban. Feltételezzük, hogy a CPT1 és CPT2 aktivitás csökkenése másodlagos lehet a DHAP és/vagy semleges zsír felhalmozódása miatt a citoplazmában. A de-novo zsírsav-bioszintézis és a zsírsav-megnyúlás köztiterméke, a Malonyl CoA köztudottan alloszterikusan gátolja a CPT-t. 13.
A GPD1 hiány diagnózisa jelentős hatással volt a beteg kezelésére. A korábban átgondolt májtranszplantációt a molekuláris diagnózis után nem javasolták. Ez részben a GPD1 mutációval rendelkező betegek eredményein alapult. 2 A Közel-Keletről származó GPD1-kötéseket hordozó mutánsok csoportjában a legidősebb beteg 23 éves volt, és tünetmentes volt. Ezenkívül a tíz érintett beteg közül nyolcban a trigliceridszint az idő múlásával csökkent.
Összefoglalva: a GPD1 hiány a súlyos hipertrigliceridémiával és a NASH-val társuló glükóz- és lipidutak hibája. A WES ebben az esetben diagnózist adott, amikor kiterjedt klinikai vizsgálatok nem azonosították az okot. A molekuláris diagnosztika előzetes információkat nyújtott a család számára, és irányította a klinikai menedzsmentet. Bár a fejlesztés jelenleg megfelelő, ezt a beteget szoros megfigyelésre szorulják, mivel a GPD1-hiány zavarhatja a glicerin-foszfát-ingát, és nem teszi lehetővé, hogy bizonyos sejtek teljes energiáját glikolízisből nyerjék, különösen azokban az agysejtekben, amelyekre nem teljesen támaszkodnak. malát- és aszpartát-shuttle oldat citoszol redukciós ekvivalensek juttatására a mitokondriális mátrixba.
- Az étrendi só hatására az SM 2021-es betegségre fejlődik
- Elle Mi okozza ezt és miért van szüksége azonnali kezelésre - Ygeia 2021
- Hepatomegalia a máj megnagyobbodását okozza - Betegségek 2021
- Ena és az úrnője megölték fiukat († 9) Szúrás után meg akarták grillezni!
- Ferenc József gyógyvíz Glauberrel és forró sóval 700 ml