elemeket
absztrakt
Ennek a vizsgálatnak a célja a halálozás és a deformitás dózis-válasz viszonyának meghatározása volt a zebraföldi élet korai szakaszában a SeMet gradált dózisú embriók mikroinjekciója után, valamint a Se-indukálta fejlődési toxicitás lehetséges mögöttes mechanizmusainak vizsgálata. Sok előnye van annak, ha a zebrafish-t fejlesztési toxikológiai és embriómanipulációs vizsgálatokhoz használják. A zebrafish átlátszó és nem tapadó embriókat állít elő, amelyek elősegítik a vegyszerek sikeres mikroinjekcióját 26, 27, 28. Tekintettel a zebrafish fejlődésbiológiájáról és genomjáról rendelkezésre álló széleskörű információkra, a fejlődés toxikológiai vizsgálata könnyen elvégezhető ezen a halfajon 27, 28 .
az eredmény
Szelénkoncentrációk
A mért és a nominális Se koncentrációk közvetlenül arányosak voltak az egyes kezelési csoportokkal. A mért Se koncentráció a kontroll, 8, 16 vagy 32 ug Se/g száraz tömeg (dm) mikroinjektált csoportokban 1,6 ± 0, 1, 11, 0 ± 0, 6, 18, 7 ± 1, 0 és 29,3 ±. 0,5 ug Se/g dm. Jelentősen magasabb Se-koncentrációt figyeltek meg a 8, 16 vagy 32 ug Se/g dm-rel mikroinjekciózott tojásokban, összehasonlítva a szérummentes Danieau-oldattal (kontroll) mikroinjektált tojásokkal (p 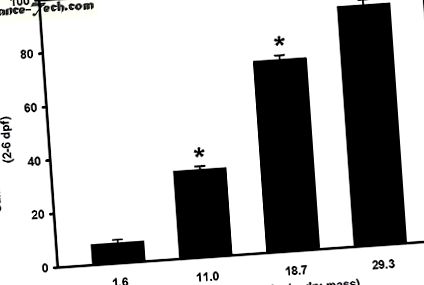
* Jelentős különbség a kontroll csoporthoz képest, egyirányú ANOVA-val, majd Dunnett-teszt alkalmazásával (p
* Jelentős különbség a kontroll csoporthoz képest, egyirányú ANOVA-val, majd Dunnett-teszt alkalmazásával (p
Kép A normális (kontroll) halat mutat, B kyphosis és lordosis látható, C ödémát mutat, D scoliosist mutat, E ábrázolja az uszony deformitásait és F többszörös deformitással és szívburok ödémával rendelkező lárva hal.
Teljes méretű kép
Az antioxidáns reakcióknak való kitettség hatásai
Az nrf2a és nrf2b feliratok, az 1a glutation-peroxidáz (gpx1a), a pi 1 és 2 glutation S-transzferáz (gstp1 és gstp2), a 2 aril-szénhidrogén receptor (ahr2) és a fehérje tirozin-1b foszfatáz (ptp1b) feliratait 48, 72 és 96-nál határoztuk meg. órákkal a megtermékenyítés után (hpf) a kontroll és 10 ug mikroinjekciós csoportokban lévő zebrafish lárvákban Se/g dm. Az nrf2a és az nrf2b szabályozását a SeMet-nek kitett csoportból származó zebrafish-ban 72 és 96 hpf-nál figyelték meg a kontroll csoporthoz képest (4A. Ábra, B). A felesleges nrf2a transzkriptum szignifikánsan nagyobb felszabályozását figyelték meg 96 hpf mellett, míg az nrf2b transzkriptumok száma szignifikánsan megnőtt mind 72, mind 96 hpf mellett (p
A 2a faktor (nrf2a) felesleges átirata ( B ) nrf2b, ( C ) glutation S-transzferáz pi1 (gstp1), ( D ) gstp2, ( E ) aril-szénhidrogén-receptor 2 (ahr2), ( B ) nrf2b, ( C ) gstp2, ( E ) aril-szénhidrogén-receptor 2 (ahr2)) és ( F ) fehérje-tirozin-foszfatáz 1B (ptp1b) zebrafish-ban embrió mikroinjekcióval vagy 10 μg Se/g dm-nek van kitéve szelenometionin vagy kontrolloldat (Danieau) formájában. A transzkriptumfelesleget kvantitatív valós idejű PCR-rel határoztuk meg 48, 72 és 96 órával a megtermékenyítés után (hpf). * Jelentősen különbözik a hallgatói t-tesztet használó kontrollcsoporttól (p
Felesleges átirat ( A ) metionin-adenozil-transzferáz 1a (mat1a); a ( B ) mat2ab zebrafish-ban vagy 10 μg Se/g dm-nek szelén-metionin vagy kontrolloldat (Danieau) hatásának van kitéve embrió mikroinjekcióval. A transzkriptumfelesleget kvantitatív valós idejű PCR-rel határoztuk meg 48, 72 és 96 órával a megtermékenyítés után (hpf). * Jelentősen különbözik a hallgatói t-tesztet használó kontrollcsoporttól (2., 3., 29. p.). Ebben a vizsgálatban az embriókeltetés jelentős csökkenése, a mortalitás és a deformitások dózisfüggő növekedése, valamint az nrf2a átiratok bőségének megváltozása volt, Az nrf2b, gstp2, ahr2, ptp1b, mat1a és mat2ab az élet korai szakaszában. Környezetvédelmi szempontból relevánsak voltak ebben a vizsgálatban, és ilyen koncentrációkat rögzítettek a Se. 11, 29, 29, 30 szennyezett vízi ökoszisztémákból gyűjtött halakban. .
A sejtekben a fehérje-tirozin-kinázok (PTK) és a fehérje-tirozin-foszfatázok (PTP-k) aktivitása egyensúlyban van, amelyek kulcsszerepet játszanak a sejtjelzésben és az állatok fejlődésében 42, 43, 44. Az oxidatív stressz és a vegyi anyagok, köztük a SeMet expozíciója kimutatták, hogy gátolja a transzkriptum bőségét és/vagy a fehérjetirozin-foszfatáz 1B aktivitását in vitro és in vivo 25, 42, 45, 46. Korábbi tanulmányok kimutatták a ptp1b szerepét a sejtek adhéziójában, az angiogenezisben, az apoptózisban és a sejtek vándorlásában, 43, 47, 48, a kritikus folyamatokban a gerinces embriók fejlődésében. Ezért megvizsgáltuk a ptp1b transzkriptumok számát a zebrafish-élet korai szakaszában, miután a tojás mikroinjekcióval a SeMet feleslegben fejlődési expozíció után kitettük magunkat, és megfigyeltük, hogy a SeMet a ptp1b-transzkriptum jelentősen lefelé szabályozott bőségét okozta 48 hpf-nál. Ez a megállapítás arra utal, hogy a fehérje-tirozin-foszfatáz aktivitás módosítása szintén szerepet játszhat a zebrafish-ban a szérum által kiváltott fejlődési toxicitásban.
Összefoglalva, eredményeink azt sugallják, hogy a SeMet szabad forma nagyobb koncentrációjának tárolása a petékben a halak korai szakaszában inkább a pusztulást, mint a deformációt okozza. A SeMet feleslegének fejlődési expozíciója embrió mikroinjekcióval megváltoztatta az oxidáns-reagáló transzkripciós faktorok, az nrf2a és az nrf2b, valamint a gstp1, gstp2, ptplb, ahr2, matla és mat2ab gén expresszióját. Ezek az eredmények azt jelzik, hogy a SeMet-nek kitett zebrafish-t meghaladó fejlődési toxicitás oka lehet oxidatív stressz vagy csökkent metiláció, vagy ezek kombinációja. Végül tanulmányunk azt mutatja, hogy az embrió mikroinjekciós technikák sikeresen alkalmazhatók a teratogén vegyszerek toxicitási mechanizmusainak vizsgálatára a zebrafish élet korai szakaszában.
mód
Tesztvegyület
A szeleno-L-metionint a Sigma-Aldrich-től (Oakville, ON, Kanada) szereztük be. A vegyület tisztasága meghaladta a 98% -ot.
Vizsgálati állat
Az ebben a tanulmányban elfogadott összes halelhelyezési és kísérleti eljárást a Saskatchewani Egyetem Állatkutatási Etikai Tanácsa jóváhagyta (20030076-as jegyzőkönyv), és betartotta a kanadai tanácsot az állatokban felhasználandó állatok gondozásához. . Felnőtt vad típusú zebrafish-t (AB törzs; kb. 4-5 hónapos) egy helyi beszállítótól vásároltunk, és egy környezettel szabályozott hőmérsékletű kamrába (28,0 ± 1,0 ° C) és egy fotoperiódust (14 órás és 10 órás sötét fényt) helyeztünk ).) A hal átlagos nedves testtömege 0,366 ± 0,019 g volt. A kifejlett halakat a tenyésztés előtt 4 héttel laboratóriumi körülményekhez igazítottuk. Az akklimatizációs periódus alatt a halakat Nutrafin® alappehely takarmánnyal (Hagen Inc., Montreal, QC, Kanada) és tisztított kiromokkal (Bio-Pure Blood Worms, Hikari Sales Inc., Hayward, CA, USA) etettük.
mikroinjekciók
Ezenkívül a Se-tojás koncentrációját okozta, ami 20% -os mortalitást okozott (
10 μg Se/g dm), és ezt a dózist a sárgájába injektáltuk, hogy meghatározzuk az oxidáns-érzékeny gén mRNS-ek (nrf2a, nrf2b, gpx1a, gstp1 és gstp2) mennyiségét. ), a metionin katabolizmusában szerepet játszó enzimek (mat1a, mat2a, mat2aa és mat2ab), ahr2 és ptp1b 48, 72 és 96 hpf zebrafish-on.
Deformáció elemzése
A teljes törzselemzést 6 dpf lárva zebrafish-on végeztük. A deformitáselemzés részletes eljárását már korábban kifejtettük. Röviden: a zebrafish lárvákat eufanizáljuk pufferolt tricaine-metánszulfonát (MS-222) (Sigma-Aldrich, Oakville, ON, Kanada) túladagolásával, és 10% pufferolt formalinban tartjuk 12 órán át, mielőtt 70% -os etanolba helyeznénk. Az egyes lárvák csontvázi, kraniofacialis és borda deformitását és ödémáját vizsgáltuk Olympus SZ-CTV boncoló mikroszkóp modell (Olympus, Melville, NY, USA) alkalmazásával, és minden hal esetében rögzítettük a fejlődési rendellenességek jelenlétét vagy hiányát. A deformitások teljes százalékát úgy számítottuk ki, hogy a rosszul alakult lárva halak számát elosztottuk a lárvák teljes számával, és megszoroztuk 100-mal.
A szelén mennyiségi meghatározása
Az összesített Se koncentrációt az egyesített tojásmintákban induktívan kapcsolt plazma tömegspektrometriával (ICP-MS) mértük a Toxikológiai Központban (Saskatchewani Egyetem, Saskatoon, SK, Kanada). Mindegyik kezelési csoportból 45-50 összevont tojás n = 3-4 ismétlődését gyűjtöttük a Se mennyiségi meghatározásához. A Se elemzésének részletes eljárását korábban 3, 59 írták le. A 0,13 μg Se/g mennyiségi meghatározási határértéket (LOQ) módszeres vakokkal határoztuk meg. A petesejtekben lévő szérumkoncentrációkat nedves alapon mértük, és száraz tömegre konvertáltuk a zebratojások egy részében meghatározott 92,5% -os nedvességtartalom alapján.
Valós idejű láncreakció (Q-PCR)
Az enzimeket vagy az érdeklődésre számot tartó transzkripciós faktorokat kódoló gének MRNS expresszióját kvantitatív polimeráz láncreakció (Q-PCR) alkalmazásával számszerűsítettük. Az összes RNS-t 20 embrió és/vagy zebrafish lárva n = 3-5 replikátumából extraháltuk minden egyes kezelési csoportból az RNeasy Lipid Tissue Mini Kit (Qiagen, Mississauga, ON, Kanada, Kanada) felhasználásával, a gyártó utasításainak megfelelően. A tisztított teljes RNS-t NanoDrop ND-1000 spektrofotométerrel (NanoDrop Technologies, Wilmington, DE, USA) számszerűsítettük. A QuantiTect® reverz transzkripciós készletet (Qiagen) használtuk a cDNS szintetizálására az összes RNS 1 μg-jából. Az RNS extrakciójának és a cDNS szintézisének részletes eljárásait máshol magyarázták 25 .
A valós idejű kvantitatív PCR-t 96 lyukú PCR lemezeken végeztük ABI 7300 Real-Time PCR rendszer alkalmazásával (Applied Biosystems, Foster City, CA, USA). A génspecifikus primereket a célgének ellen terveztük Primer 3 szoftver segítségével, és bemutattuk a primer szekvenciákat (2. táblázat). A részletes Q-PCR eljárásokat máshol magyarázták 25. A transzkript célgén előfordulását az 1a megnyúlási faktor (ef1α) expressziójának normalizálásával számszerűsítettük az MNE módszerrel (Mean Normalized Expression Mean), Simon (2003) 60 szerint. .
Asztal teljes méretben
Statisztikai analízis
Az összes statisztikai elemzést a Sigmaplot 11 (Systat Software Inc., San Jose, CA, USA) segítségével végeztük. Az adatokat a normalitás szempontjából Shapiro-Wilk teszttel, a szóródás homogenitását pedig a Levene teszttel teszteltük. Azokat az adatokat, amelyek nem feleltek meg a paraméteres statisztikai eljárások követelményeinek, log 10-vé alakítottuk át. A nem transzformált adatokat minden ábra mutatja. Jelentős különbségeket mutat a petesejtekben, az embrió keltetőhelyben, valamint a zebrafish halandósága és mortalitása, valamint a korai élet deformációi a kontroll és az osztályozott SeMet mikroinjekciós csoportokból egyirányú ANOVA-val, majd Dunnett-teszt segítségével tesztelték. Az antioxidáns, metiláció, AhR és fehérje-foszfatáz gének felesleges transzkriptumát a zebrafish-aktivitáshoz kapcsolódóan a kontrollcsoportból és a 10 μg-os csoportokból Se/g dm-vel injektálva 48, 72 és 96 hpf-on teszteltük hallgatói t-teszt alkalmazásával. Az adatokat átlag ± SEM-ben fejeztük ki. A különbségeket statisztikailag szignifikánsnak tekintettük p-nél
- Milan Šamánek A borivás jelentősen csökkenti a szívroham vagy a cukorbetegség kockázatát
- Liptovský Ján - Miniatűr Park MINI Szlovákia Jánská Dolina elején
- Az anyukák tanácsot adnak az anyukáknak a hatodik betegségről - már megvolt, milyen tünetek voltak
- Sárga dinnye
- Liraglutid, GLP-1 RA, PCOS betegek
