absztrakt
Az endomorfin-2-t (Tyr-Pro-Phe-Phe-NH2; EM-2) és az endomorfin-1-et (Tyr-Pro-Trp-Phe-NH2; EM-1) szarvasmarháktól izolálják (Zadina és mtsai, 1997). mint emberi agyak (Hackler és mtsai., 1997), és a mu-opioid receptor endogén ligandumának tekinthetők (Goldberg és mtsai., 1998; Zadina és mtsai., 1997). Az EM-2 és az EM-1 immunreaktivitása kiemelkedően jelen van azokon a területeken, ahol a mu receptorok koncentrálódnak. Nagy mennyiségű EM-2-szerű immunreaktivitást (Schreff és mtsai, 1998) és EM-1-szerű immunreaktivitást (Martin-Schild és mtsai, 1999) találtak a nucleus accumbens-ben (NAc), amely az opiátok különböző altípusait tartalmazza . receptorok (mu-, kappa és delta-opioid receptorok). Farmakológiailag ez a két endomorfin erős fájdalomcsillapító és hasonló tulajdonságokkal rendelkezik (Goldberg et al., 1998). Mind az EM-2, mind az EM-1 rövid hatású naloxon-érzékeny antinociceptiókat eredményez a farokcsapás tesztben (Stone és mtsai, 1997). A farmakológiai intervenciós vizsgálatok azonban azt is kimutatták, hogy a két endomorfin hatásmechanizmusa nem teljesen azonos. Így az EM-2 antinociceptív hatása érzékenyebb a naloxonazinra, mint az EM-1 (Sakurada és mtsai, 1999, 2000, 2001, 2002). Sakurada és mtsai tanulmányai azt sugallták, hogy az EM-2 túlnyomórészt mu1-opioid receptor agonistaként, az EM-1 pedig mu2-opioid receptor agonistaként működik.
A mu-opioid receptorok aktiválása NAc-ben a dopamin felhalmozódásának kiáramlásának nagy és gyors növekedését idézi elő. Így a fentanil, a mu receptor agonista, növeli az a-dopamin dopamin naloxon reverzibilis kiáramlását (Yoshida és mtsai, 1999). Az EM-2 és az EM-1 azon képességét, hogy szabadon mozgó patkányokban módosítsa a felhalmozódott dopamin extracelluláris mennyiségét, nem vizsgálták. Ezért elemeztük az EM-2 és az EM-1 hatását az extracelluláris dopamin mennyiségére a szabadon mozgó patkányok NAc-jében, egy nemrégiben továbbfejlesztett mikrodialízis technikával, amely lehetővé teszi a dopamin on-line monitorozását 5 perc időfelbontással. 20 perc (Saigusa et al., 2001; vö. Fusa et al., 2002, 2005; Murai et al., 1994; Saigusa et al., 1997, 1999; Takada et al., 1993; Tomiyama et al., 1993 ., 1995).
KÍSÉRLETI ELJÁRÁSOK
A kísérlet elején 200 és 220 g közötti hím Sprague-Dawley patkányokat (NRC Haruna, Japán) használtunk. Hőmérséklet-szabályozott környezetbe helyezték őket 12 órás világos-sötét ciklusban (világos periódus 0700-1900 óra), szabad hozzáféréssel az élelemhez és a vízhez.
sebészet
A patkányokat nátrium-pentobarbitonnal (50 mg/kg, intraperitoneálisan (ip)) altattuk. Az altatott állatokat sztereotaxiás készülékbe helyeztük, és egy vezető kanült (AP 10,6 mm, ML 1,5 mm, DV 4,0 mm az interaurális vonaltól; Paxinos és Watson, 1998) közvetlenül a bal NAc fölé ültettük be a fent leírt eljárásokkal (Fusa és mtsai, 2002, 2005; Saigusa és mtsai, 1997, 1999, 2001). A kamrai rendszer elkerülése érdekében az NAc-re irányított kanülök 18 ° -kal dőltek el a szagittális középsíktól. A műtét végén a patkányokat 7-10 nappal a kísérletek előtt hagyták helyreállni; a vezető kanüleket rozsdamentes acél betétekkel szabadalmaztatták. Minden állatot csak egyszer alkalmaztak. A kísérleteket az állatgondozásra és állatjólétre vonatkozó intézményi, nemzeti és nemzetközi irányelveknek megfelelően hajtották végre. Minden erőfeszítést megtettek az állatok szenvedésének minimalizálása és a felhasznált állatok számának csökkentése érdekében.
Dialízis és neurokémiai mérések
drogok
Az alkalmazott gyógyszerek: EM-2 (Peptide Institute Inc., Oszaka, Japán), EM-1 (Peptide Institute Inc., Osaka, Japán), TTX (Sigma-RBI, St. Louis, MO, USA), CTOP (Sigma) -RBI St Louis, MO, USA), naloxon (Sigma-RBI, St Louis, MO, USA) és naloxonazin (naloxonazine dihidroklorid; Sigma-RBI, St Louis, MO, USA). Az EM-2-t, az EM-1-et és a CTOP-ot feloldottuk módosított Ringer-oldatban. Az EM-2-t és az EM-1-t a dialízis membránon keresztül 25 percig, míg a CTOP-t hasonlóan 50 percig (az EM-2 és az EM-1 infúziója előtt 25 perccel) infundálták. A TTX nátriumcsatorna-blokkolót feloldottuk a módosított Ringer-oldatban a perfúzióhoz való felhasználáshoz, és dialízisszondán keresztül intracerebrálisan adtuk be. A naloxont sóoldatban oldjuk. A naloxonazint 2,5% -os Tween-80 oldatban szuszpendáltuk, és 24 órával az EM-2 infúzió megkezdése előtt adtuk be. Az alkalmazott dózisok a fenti kísérletek eredményein alapultak (EM-2 és EM-1: Sakurada és mtsai, 2001; TTX: Fusa és mtsai, 2002; Saigusa és mtsai, 2001; Takada és mtsai, 1993; Tomiyama és mtsai. És mtsai., 1993, 1995, CTOP: Yoshida és mtsai., 1999, naloxon: Yoshida és mtsai., 1999, naloxonazin: Piepponen és Ahtee, 1995). A jelentett EM-2 és EM-1 dózisok a vegyületek mennyisége (nmol) voltak 25 perc perfúziós folyadékban (50 μl), a CTOP dózisa pedig a vegyület mennyisége 50 perc perfúziós folyadékban (100 μl).
szövettan
A kísérlet végén a patkányokat nátrium-pentobarbitonnal (50 mg/kg, ip) mélyen altattuk és transzkardiálisan 10% formaldehid-oldattal mostuk. Az agyat eltávolítottuk, szekcionáltuk (50 μm) és krezil-ibolyával festettük, hogy lehetővé tegyük a szonda elhelyezését.
Statisztikai analízis
Valamennyi értéket az alapszint százalékában fejeztük ki. Az időbeli lefolyás összehasonlítását kétirányú ANOVA (varianciaanalízis) alkalmazásával végeztük a kezeléssel és az időfaktorokkal (ismételt) végzett ismételt mérésekhez. A statisztikai szignifikanciát P-nek tekintettük 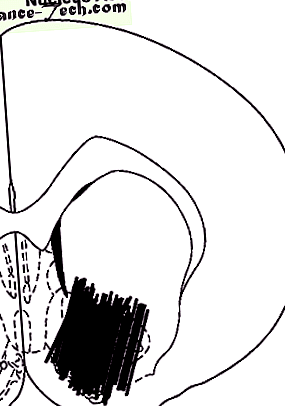
A próba helyének sematikus ábrázolása NAc-ben. A diagram Paxinos és Watson atlaszából származik; a szám az elülső távolságot (mm) jelenti az interaurális vonaltól.
Teljes méretű kép
Az extracelluláris dopamin alapszintje NAc-ben
A kezdeti dopamin-koncentráció az NAc-dializátumokban 1,0 ± 0,05 pg/5 perc volt (átlag ± SEM; n = 159).
Az EM-2 és az EM-1 perfúzió hatása az extracelluláris dopamin szintre NAc-ben
25 perces infúzió: EM-2 (2a. Ábra; 5 nmol (n = 7), 25 nmol (n = 6) és 50 nmol (n = 6)) vagy EM-1 (2b. Ábra; 5 nmol (n = 6) )), 25 nmol (n = 6) és 50 nmol (n = 6) - NAc dózisfüggő módon az extracelluláris dopamin szintjének dózisfüggő növekedését indukálta: ezek a hatások körülbelül 10–35 percig tartottak (EM-2 - F kezelés (2, 96) = 84, 92, P
a) A vivőanyag-infúzió (n = 6, gyémántokkal töltött), 5 nmol EM-2 (n = 7, nyitott négyzetek), 25 nmol EM-2 (n = 6, töltött háromszögek) és 50 nmol EM-2 hatása (n = 6, nyitott körök) NAc-ra az bazális extracelluláris dopamin (DA) szinteken NAc-ben. Az adatokat a 25 perces EM-2 infúzió megkezdése utáni 5 perces megfigyelési periódusok átlagos változásaként fejezzük ki. A függőleges vonalak jelzik a SEM-et. Az x tengely fölött töltött sáv jelzi a vivőanyag vagy az EM-2 infúziós idejét. b) A vivőanyag-infúzió (n = 6, gyémántokkal töltött), 5 nmol EM-1 (n = 6, nyitott négyzetek), 25 nmol EM-1 (n = 6, töltött háromszögek) és 50 nmol EM-1 hatása (n = 6, nyitott körök) NAc-ra az bazális extracelluláris dopamin (DA) szinteken NAc-ben. Az adatokat az EM-1 25 perces infúziójának megkezdése után 5 perces megfigyelési periódusok átlagos változásaként fejezzük ki. A függőleges vonalak jelzik a SEM-et. Az x tengely fölötti kitöltött sáv jelzi a vivőanyag vagy az EM-1 infúziós idejét.
Teljes méretű kép
Az EM-2 és az EM-1 által kiváltott átmeneti dopamin efflux-növekedés neuronfüggése NAc-ben
A TTX-t (2 μM) 2 órán át infundálva dialízisszondával körülbelül 70% -kal csökkentette a bazális DA szint. Ez a TTX infúzió szinte teljesen megszüntette az EM-2-t (50 nmol; n = 6; 3a. Ábra; F-kezelés (1, 60) = 421, 58: P
(a) 2 μM TTX perfúziójának hatása 50 nmol EM-2 25 perces infúzióval indukálta a DA (dopamin) szint emelkedését az NAc-ben (n = 6, nyitott háromszögek). Az adatokat a 25 perces EM-2 infúzió megkezdése utáni 5 perces megfigyelési periódusok átlagos változásaként fejezzük ki. A függőleges vonalak jelzik a SEM-et. Az x tengely feletti nyitott rúd a TTX perfúzió periódusát mutatja, amely 120 perccel az EM-2 infúzió megkezdése előtt kezdődött. A kitöltött vonal jelzi az EM-2 infúziós idejét. (b) 2 μM TTX perfúziójának hatása 50 nmol EM-1 25 perces infúzióval indukálta a DA (dopamin) szint növekedését az NAc-ben (n = 6, nyitott háromszögek). Az adatokat az EM-1 25 perces infúziójának kezdete után 5 perces megfigyelési periódusok átlagos változásaként fejezzük ki. A függőleges vonalak jelzik a SEM-et. Az x tengely feletti nyitott rúd a TTX perfúzió periódusát mutatja, amely 120 perccel az EM-1 infúzió megkezdése előtt kezdődött. A kitöltött vonal jelzi az EM-1 infúziós idejét.
Teljes méretű kép
A Mu-opioid receptor antagonista hatása az EM-2- és EM-1 által kiváltott dopamin efflux tranziens növekedésére NAc-ben
Az NAc perfúziója a mu-opioid receptor antagonista CTOP-val (3 nmol; n = 6) nem befolyásolta az EM-2 által kiváltott dopamin felhalmozódás extracelluláris mennyiségének növekedésének intra-akkumulált infúzióját (50 nmol; n = 6). (4a. Ábra; F kezelés (1, 57) = 3, 28, P = 0,08; F idő (5, 57) = 5, 30, P
Teljes méretű kép
A naloxon hatása az EM-2- és EM-1 által kiváltott dopamin fluxus tranziens növekedésére NAc-ben
Amint az 5a. Ábra mutatja, a naloxon (1 mg/kg, ip, 20 perccel az intracerebrális perfúzió előtt beadva), amely önmagában nem befolyásolta jelentősen a felhalmozódott dopamin alapszintjét (az adatokat nem mutatjuk be), nem befolyásolta az EM-2-t (50 nmol ) indukálta a NAc dopaminszintjének növekedését (n = 6). A naloxon várható hatékonyságának növelése érdekében a naloxont az EM-2 beadása előtt 20 perccel 10-kor adták be; A naloxon ismét teljesen képes volt gátolni az EM-2 (50 nmol) hatását az NAc dopaminszintjére (5b. Ábra, n = 9). Mint fent említettük, a 25 nmol EM-1 hatásai többé-kevésbé összehasonlíthatók az 50 nmol EM-2 hatásaival. Ezért kezdetben teszteltük a naloxon (1 mg/kg, ip, intracerebrális perfúzió előtt 10 perccel beadott) képességét, amely önmagában nem befolyásolta szignifikánsan a felhalmozódott dopamin alapszintjét (az adatokat nem közöltük), hogy antagonizáljon 25 nmol EM -1 . Ez a kezelés szignifikánsan csökkentette az EM-1 által indukált dopaminszint (25 nmol) növekedését az NAc-ben, különösen a kezdeti 10-30 perces periódusban (n = 9; 5c. Ábra; F kezelés (1, 78) = 42, 49, P
Teljes méretű kép
VITA
Korábban kimutattuk, hogy az alapszintű NAc dopaminszintje nagymértékben függ az idegsejtek aktivitásától, mivel a dopamin felszabadulás több mint 70% -a érzékeny a TTX-re (Saigusa és mtsai, 2001). Ezért az ebben a vizsgálatban mért bazális dopamint szintén elsősorban a dopamin neuronok általi felszabadulásának köszönhetik.
Az EM-2 és az EM-1 intraakrális infúziója dózisfüggően növelte a NA-patkányok dopamin-dializátum-szintjét. Kvantitatív különbséget figyeltek meg az EM-2 és az EM-1 hatása között a dopamin-felhalmozódás kiáramlásának növekedésére. Tehát az EM-2 képessége a felhalmozódott extracelluláris dopaminszint növelésére sokkal kisebb volt, mint az EM-1 képessége, amikor dózisok széles tartományában (5, 25 és 50 nmol) tesztelték. Az EM-2 és az EM-1 legnagyobb dózisú (50 nmol) infúziójának maximális hatásait szinte teljesen elnyomta a TTX (2 μM) intra-akkumulált infúziója, ami arra utal, hogy a jelenlegi kísérleti körülmények között a felhalmozott dopaminszint növekedése Az EM-2- és EM-1 teljes mértékben függ a neuronaktivitástól. Amint az alábbiakban tárgyaltuk, az EM-1 hatásait olyan mechanizmusok közvetítették, amelyek teljesen eltérnek az EM-2 hatásait közvetítő mechanizmusoktól. Ezért az EM-1 és az EM-2 közötti hatékonyságbeli különbségek nem egyszerűen az affinitás és/vagy a belső aktivitás különbségének tulajdoníthatók, hanem a mechanizmusok különbségének.
Ez a tanulmány együttvéve azt mutatja, hogy az EM-2 és az EM-1 intra-akkumulált infúziója teljesen eltérő mechanizmusokkal növeli az NAc dopamin kiáramlását. Bár mind az EM-2, mind az EM-1 hatása az idegsejtek aktivitásától függ, az EM-2 hatásait a szelektív muopioid receptor antagonista CTOP vagy a specifikus opioid receptor antagonista naloxon egyébként hatékony dózisa nem tudta gátolni. az EM-1 hatásai, amelyeket nagyon hatékonyan elnyomtak: CTOP, naloxonazin és naloxon. Arra a következtetésre jutottak, hogy az EM-2 hatásait nem a naloxon-érzékeny opioid receptorok közvetítik, ellentétben az EM-1 hatásával, amelyet az NAc mu1-opioid receptorai közvetítenek.
köszönöm
Ezt a tanulmányt a Sato Fund (TS, NK) és a Fogászati Kutatóközpont (NK), a Nihoni Egyetem Fogorvostudományi Karának kutatási támogatásai támogatták; Nihoni Egyetem Multidiszciplináris Kutatási Grant 2005/2006 (TS, NK, ARC); támogatás egy multidiszciplináris kutatási projekt (NK, ARC) támogatására és a tudományos kutatás támogatásához nyújtott támogatás (# 14 370 609 az NK-nál és # 16 591 897 a TS-nél) az Oktatási, Kulturális, Sport-, Tudományos és Technológiai Minisztériumtól, Japán; és a Társaság a Japán Magániskola Támogatásáért és Kölcsönös Segítségéért (SW, IT, YA, NK).
