elemeket
absztrakt
A bél mikroflóra változásai kulcsszerepet játszanak a gazda fiziológiájában és anyagcseréjében; az étrend okozta elhízás e változásainak hátterében álló molekuláris utak azonban nem tisztázottak. A rapamicin jelátviteli út (mTOR) mechanisztikus célpontja olyan anyagcsere-rendellenességekkel társul, mint az elhízás és a 2-es típusú cukorbetegség (T2D). Ezért azt vizsgáltuk, hogy az étrend okozta változások az mTOR jelátvitel (magas zsírtartalmú étrend [HFD] vagy étrenddel táplált étrend) és/vagy a terápiás szerek (resveratrol [az mTOR 1 komplex specifikus inhibitora]] vagy rapamicin [mindkettő inhibitora] szabályozásában mTOR 1 komplexek és 2]) megváltoztatta az egerekben a bél mikroflóra összetételét. A resveratrol orális beadása megakadályozta a glükóz intoleranciát és a zsír felhalmozódását a HFD-vel táplált egerekben, míg a rapamicin jelentősen rontotta a glükóz toleranciát és a bélgyulladást. A Lactococcus, a Clostridium XI, az Oscillibacter és a Hydrogenoanaerobacterium bősége HFD körülmények között nőtt; e fajok bősége azonban csökkent a resveratrol-kezelés után. Ezzel szemben a nem osztályozott Marinilabiliaceae és Turicibacter száma csökkent a HFD vagy a rapamicin hatására. Ezek az eredmények együttvéve azt mutatták, hogy az mTOR aktivitás változásai által kiváltott bél mikrobiosis összetétel változásai korrelálnak az elhízott és a diabéteszes fenotípusokkal.
Az elhízás a különböző krónikus betegségek, köztük a 2-es típusú cukorbetegség (T2D), a szív- és érrendszeri betegségek, a magas vérnyomás, az alkoholmentes zsírmájbetegség és a rák 1 fő kockázati tényezője. Az elhízás kiváltó oka a táplálékból származó energia és az energiafelhasználás közötti egyensúlyhiány a bazális anyagcsere, a fizikai aktivitás és a termogenezis révén 2. Mivel a bazális anyagcsere (BMR) az összes energiafelhasználás körülbelül 60-75% -át teszi ki 2, az alacsony testtömeg-BMR az elhízás egyik kockázati tényezője 3. Ezenkívül az energiaegyensúlyt a genetikai, környezeti és pszichoszociális tényezők komplex kölcsönhatásai is befolyásolják 4. Az energiafogyasztást tekintve a gyomor-bél (GI) motilitásának változásai hozzájárulnak az elhízáshoz azáltal, hogy nemcsak az emésztés hatékonyságát, hanem az étvágyat és a jóllakottságot is szabályozzák 5. Érdekes módon a legújabb tanulmányok azt sugallják, hogy a bél mikroflóra fontos szerepet játszik az energiagyűjtésben és az elhízásban a GI motilitásával való kölcsönhatás révén. 6, 7 .
Itt megvizsgáltuk a resveratrol és a rapamicin mTOR jelátvitelre, metabolikus marker expressziójára és a bél mikroflóra összetételére gyakorolt hatását mind normál, mind DIO egerekben. Az eredmények azt mutatják, hogy a resveratrol és a rapamicin nemcsak az mTOR jelátviteli aktivitására és a metabolikus markerek expressziójára, hanem a bél mikroflóra összetételére is jelentős hatást gyakorol, ami arra utal, hogy a specifikus mikrobiális csoportok korrelálnak az elhízással és a T2D-vel társuló patofiziológiai fenotípusokkal.
az eredmény
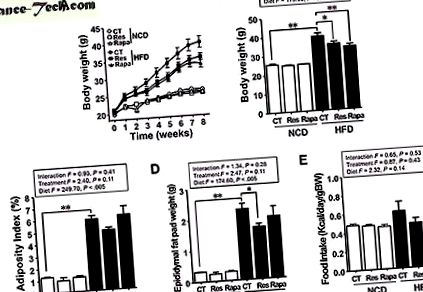
A resveratrol, de nem a rapamicin, enyhíti a HFD által kiváltott elhízást
A várakozásoknak megfelelően a testtömeg (BW) és a zsírraktározás a HFD-vel táplált egerekben magasabb volt, mint a normál étrenddel etetett egerekben (NCD) (P
( A, B ) Vércukorszint (ismételt mérés kétirányú ANOVA Bonferroni post hoc teszt után, F = 13, 88; P * P ** P # P ## P * P ** P * P ** P 24 és a vastagbél hossza. Koncentráció Az LCN-2 széklet HFD-CT egerekben szignifikánsan magasabb volt, mint az NCD-CT egerekben (P
A baktériumközösségeket súlyozatlan UniFrac távolság-alapú elemzéssel (PCoA) csoportosítottuk. ( A ) Fő koordináta (PC) 1 szemben a PC2 és ( B ) PC1 és PC3. A grafikus PC százalékos eltérését a tengelyeken jelölik. ( C ) Oszlopdiagramok, amelyek bemutatják a baktériumok különböző nemzetségeinek relatív előfordulását (%) különböző étrendi és kezelési csoportokban. Az egerek minden csoportját egy másik szimbólum vagy oszlop képviseli a grafikon x tengelyén, és minden egyes folt vagy oszlop egy mintát jelöl (n = 5 csoportonként).
Teljes méretű kép
Jelentős különbségek vannak a bélbaktériumok relatív ábrázolásában a különböző étrendi és kezelési csoportokban. Hatás ( A, B ) resveratrol vagy ( C, D ) a rapamicint 7 vagy 10 baktérium nemzetség relatív számához, és ezeknek a baktériumprofiloknak a manhattani távolságok alapján történő hierarchikus csoportosítását elemeztük NCD-vel és HFD-vel táplált egerekben. Az adatokat átlag ± SEM-ként fejezzük ki (n = 5 csoportonként). Az F és p értékek kétirányú ANOVA-ból származnak Bonferroni post hoc teszt után (S2 kiegészítő táblázat). * P ** P # P ## P
A Pearson-korrelációs együtthatók olyan térképeket tartalmaznak, amelyek bemutatják a metabolikus markerek és a baktériumok számos specifikus nemzetsége közötti kapcsolatot ( A ) resveratrol vagy ( B ) rapamicin kezelés. Az elvégzett korrelációs tesztek nagy száma miatt a P 14 szignifikancia küszöböt alkalmaztuk. Mivel a metformin az mTOR szignalizáció kulcsfontosságú szabályozója, ez a tanulmány azt vizsgálta, hogy a központi gazda energia metabolizmusának alapjául szolgáló mechanizmusok, amelyeket az mTOR út differenciális szabályozása vezérel, tartalmazzák-e a bél mikroflóra összetételének változásait.
Összefoglalva, az itt közölt eredmények azt mutatják, hogy a resveratrol és rapamicin kezelés következtében a bél mikroflóra összetételében bekövetkező változások korrelálnak a DW egerek BW, zsírraktározás, inzulinrezisztencia és bélgyulladás változásával. Habár a HFD-vel kapcsolatos specifikus molekulák azonosságát, amelyek gazdagítják vagy csökkentik a bél egyes mikrobiális populációit, azonosítani kell, az mTOR szignalizáció kulcsfontosságú elemnek tűnik a bél mikroflóra összetételének szabályozásában DIO egerekben.
mód
Mintavétel
A székletmintákat 8 hetes resveratrollal vagy rapamicinnel végzett kezelés után frissen gyűjtöttük, majd -80 ° C-on tároltuk. A kezelési periódus végén az egereket izofluránnal (2-klór-2- (difluor-metoxi) -1,1 altattuk). Éjszakai böjt (16 óra) után. A májat, a beleket, az epididymális zsírpárnákat és a vérmintákat gyorsan összegyűjtöttük, rövid ideig PBS-ben mostuk és -80 ° C-on tároltuk a feldolgozásig. Az epididymális zsírpárnákat súlyoztuk az AI kiszámításához (g epididymális zsírpárnák/g BW-100). A szérumot a vérből gyűjtöttük Microtrainer® csövekkel (BD, Franklin Lakes, NJ) inzulinanalízishez.
Glükóz homeosztázis elemzés
A GTT-t vagy az ITT-t a kezelési periódus végén végeztük el. Az egyik napról a másikra táplált egerek glükózterhelést (1,5 g/testtömeg-kg) kaptak orális szondával vagy inzulintöltéssel (0,75 U/testtömeg-kg) intraperitoneális injekcióval. Vércukorszintmérőt (Accu-Check Performa, Roche) használtunk a vércukorszint mérésére glükóz vagy inzulin beadása előtt és után. A homeosztatikus modell (HOMA2) frissített értékelését, amely magában foglalja a HOMA2-IR (inzulinrezisztencia), a HOMA2 -% B (hasnyálmirigy béta sejtfunkció) és a HOMA2 -% S (inzulinérzékenység) elemeket, a QUICKI és a K ITT kiszámításához használták, amilyeneket leírtak. korábban 23, 46, 47. A HOMA2 modellt az éhomi glükóz és az éhomi inzulin szintjének felhasználásával számoltuk ki az áldozatkészítés előtt és mielőtt a glükózt bevezettük a GTT-be.
Enzimhez kapcsolt immunszorbens vizsgálat
Az mTORC1 és 2 jelátviteli komplexek aktivációjának értékeléséhez a májmintákat egy cAMP paraméter-vizsgálati készlet (egér/patkány) (R&D Systems Inc., Minneapolis, MN) alkalmazásával vizsgáltuk a cAMP-sejtek szintjére és a PathScan szendvics ELISA-készleteire (Cell Signaling Technology)., Beverly, MA) az összes S6, foszforilezett S6 (Ser235/236), valamint az összes Akt és foszforilezett Akt1 (Ser473) esetében. Az Akt1 foszforilezésének vizsgálatához 10 U perccel a vér összegyűjtése előtt 0,5 U inzulint injektáltunk testtömeg-kilogrammonként. A szérum inzulin koncentrációt az AKRIN-011T Insulin ELISA kit (Shibayagi, Gunma, Japán) alkalmazásával mértük. A bélgyulladás meghatározásához a széklet LCN-2 szintjét Quantikine ELISA készlet segítségével mértük a Lipocalin-2/NGAL cégtől (R&D Systems Inc., Minneapolis, MN), Chassaing és mtsai. 24. Valamennyi ELISA-t a gyártó protokolljai szerint hajtottuk végre.
DNS-extrakció, bakteriális 16S rRNS-gén amplifikáció és 454 piroszekvenálás
A metagenomikus DNS-t székletmintákból (mintánként 0,02 g) extraháltuk ismételt gyöngymarási módszerrel, plusz egy oszlopot a fentiek szerint 14. A baktérium 16S rRNS génjének hiper-variábilis V1 és V2 régióit minden kivont DNS-mintából a 14. vonalkódos primerek segítségével amplifikáltuk. Mintánként öt ismételt PCR terméket egyesítettünk és tisztítottunk a QIAquick PCR tisztító készlet segítségével (Qiagen, Valencia, Kalifornia). Az egyesített DNS-t 454 GS FLX Titanium piroszekvenálással szekvenáltuk (Roche 454 Life Sciences, Branford, CT). A szekvenálást Macrogen segítségével (Szöul, Korea) végeztük.
A bakteriális 16S rRNS génszekvenciák elemzése és közösségi összehasonlítás
Statisztikai analízis
Az adatokat átlag ± SEM-ben fejeztük ki. Az összes statisztikai elemzést és a Pearson-korrelációs együtthatókat GraphPad Prism szoftver (6.0 verzió; GraphPad Software, SD, USA) alkalmazásával hajtottuk végre. A Pearson-féle korrelációs együtthatós hőtérképeket Excel és PowerPoint (2010-es verzió; Microsoft Corporation, WA, USA) segítségével jelenítettük meg. A több csoportot összehasonlító kísérletek során a különbségeket kétirányú ANOVA-val elemeztük, amelyet Bonferroni post-hoc teszt követett. A GTT-t és az ITT-t elemeztük ismételt mérésekkel, kétirányú ANOVA-val, idő és csoport mint variációs forrás. P * P ** P értékek