elemeket
absztrakt
Nemrégiben beszámoltunk arról, hogy a klofaziminnak (CF) anti-piroplazma aktivitása van, de nem tudja teljesen megszüntetni a parazitákat a gazdaszervezetben. A jelenleg kapható piroplazmaellenes gyógyszer, a diminazenoacetát (DA), néha toxikus mellékhatásokkal jár. Ebben a vizsgálatban értékeltük a CF-vel és DA-val történő kombinált terápiát in vitro és in vivo piroplazákkal szemben. Ezenkívül az mRNS szintjét és a DNS mennyiségét CFP-vel és DA '-val kezelt Babesia bovis-ban elemeztük qPCR segítségével. A CF - DA kombináció additív hatást gyakorolt a Babesia bovisra, a B. bigeminára és a B. caballi-ra, valamint szinergikus hatást gyakorolt a Theileria equi-re. A B. microti elleni kombinált CF-DA kemoterápia egerekben hatékonyabb volt, mint monoterápiájuk. CF‒ és DA kezelt B. bovis esetében a CF dózisfüggő lefelé szabályozott mRNS szintje és a DNS-extranukleáris gének mennyisége (AT-gazdag), míg a DA nemcsak a DNS extranukleáris gének mennyiségét, hanem a nukleáris géneket is. a géneket kissé lefelé vagy felfelé szabályozta a CF és a DA. Végül a CF-DA kombináció nagyobb hatékonysággal rendelkezik a piroplazmákkal szemben, mint a CF vagy DA monoterápia. A CF-nek és a DA-nak AT-gazdag DNS-kötő aktivitása lehet. Minden eredmény arra utal, hogy a CF-DA kombinált kemoterápia jobb választás lesz a piroplazmózis kezelésében a DA monoterápia helyett.
A szarvasmarha babeziózisa és a ló piroplazmózisa hatalmas gazdasági veszteségeket okoz világszerte, különösen a trópusi és szubtrópusi területeken 1, 2. A jelenleg elérhető piroplazma elleni gyógyszereknek, a diminazenoacetátnak (DA) és az imidokarb-dipropionátnak néha toxikus mellékhatásai vannak 3. Ezenkívül beszámoltak DA-rezisztens Babesia gibsoni-ról és az imidokarb-dipropionát-rezisztens Theileria equi 4, 5 kialakulásáról. Ezért sürgősen kevésbé mérgező, olcsó és hatékony piroplazmaellenes kemoterápiákra van szükség.
Nemrégiben beszámoltunk arról, hogy a klofaziminnak (CF) erős gátló hatása van a piroplasiák növekedésére, de a CF nem tudta teljesen megszüntetni a B. microt egerekben 6. A CF egy antibiotikum, amelyet kombinált kemoterápiában alkalmaznak a lepra ellen. Beszámoltak arról, hogy a CF aligha vezet a rezisztencia kialakulásához 8, de Zhang és mtsai. 9 nemrégiben arról számolt be, hogy a gének számos mutációja összefügg a CF baktériumok rezisztenciájával.
Ebben a tanulmányban megvizsgáltuk a CF-DA kombináció hatását a B. bovis, a B. bigemina, a B. caballi és a T. equi in vitro növekedésére és a B. microti elleni kemoterápiás aktivitására egerekben. A növekedésgátlási vizsgálatok mellett AT-ban gazdag DNS-kötési aktivitásokat tanulmányoztunk a CF és DA hatásának módjának meghatározására B. bovis-ban kvantitatív PCR-vizsgálat (qPCR) alkalmazásával.
Eredmények és vita
Asztal teljes méretben
Asztal teljes méretben
Asztal teljes méretben
Asztal teljes méretben
Az előző 6 vizsgálattal összhangban a 20 mg/kg CF hatása hasonló volt, és néha magasabb volt, mint a 25 mg/kg DA hatása. Ezért az egérkísérletben a kombinált terápiákban alkalmazott dózis kiválasztásának 25 mg/kg-ot, a legnagyobb dózist tekintették alapul. Ezenkívül az in vivo gátlási teszt kombinációiban az egyenlőtlen dózisarányok hasonlóak az in vitro gátlási próbához. A B. microti növekedése az összes kezelési csoportban szignifikánsan gátolt (II-25 mg/kg DA, III-20 mg/kg CF, IV-15 mg/kg CF és 10 mg/kg DA és V-10 mg/kg) . kg CF és 15 mg/kg DA) a kezeletlen csoporthoz (I-0,2 ml szezámolaj és sóoldat) képest (1. ábra). Statisztikailag szignifikánsan alacsonyabb különbség (P 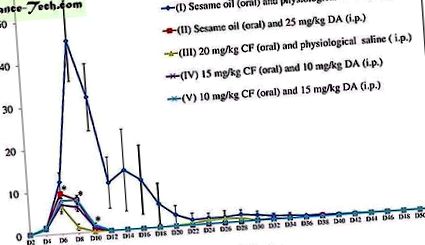
A B. microti növekedése kezeletlen (I), 25 mg/kg DA (II) -, 20 mg/kg CF (III) -, 15 mg/kg CF és 10 mg/kg DA kombinációban (IV) - és 10 egérben mg/kg CF és 15 mg/kg DA kombinációval (V) 52 napig. A nyíl 5 egymást követő kezelési napot jelöl. A csillagok statisztikailag szignifikánsak (P
Hematokrit értékek kezeletlen, 25 mg/kg DA -, 20 mg/kg CF -, 15 mg/kg CF és 10 mg/kg DA kombinációkban - és 10 mg/kg CF és 15 mg/kg DA kombinációkban kezelt egerekben . A nyíl 5 egymást követő kezelési napot jelöl. A csillagok statisztikailag szignifikánsak (P
B. mikroti PCR kimutatása CF‒ vagy DA 'kezelt egerekből a fertőzés után az 52. napon. a ) a vér DNS-mintáiban: G1, kezeletlen; G2, 25 mg/kg DA; G3, 20 mg/kg CF; G4, 15 mg/kg CF és 10 mg/kg DA kombinációja; G5, 10 mg/kg CF és 15 mg/kg DA kombinációja. ( b - f ) szöveti DNS-mintákban: M, marker 100 bp; PC, pozitív kontroll; Br. Sp., Lép; Li., Máj; Ki., Vesék; Ő, szív, NC, negatív kontroll. Néhány pozitív kontrollban megfigyelt kettős sáv az első és a második PCR amplikonjait képviseli. Csak egy sávot figyeltek meg a templát DNS koncentrációjának csökkentésére (az adatokat nem mutatjuk be). ( g ) B. microti fertőző képessége vörösvértest transzfúziós egerekben. A parazitémiát úgy számítottuk ki, hogy a fertőzött eritrocitákat 500 eritrocita között számoltuk meg.
Teljes méretű kép
A CF-DA kombinált kemoterápiák általában hatékonyabbak, mint monoterápiáik, annak ellenére, hogy az in vitro és az in vivo gátlási vizsgálatokban alkalmazott különböző adagolási rendek alkalmazandók, ezért a kombinált kemoterápia valószínűleg csökkenti a gazdaszervezet toxikus mellékhatásait. A hipotézisünk megerősítése érdekében azonban további vizsgálatokat kell végezni a CF-DA kombinációs terápiával összefüggő lehetséges toxikus mellékhatások azonosítására.
mRNS-szintek CF-vel vagy DA-val kezelt B. bovis-ban. ( a ) 4 μM CF-kezelt és DMSO-val kezelt paraziták. ( b ) 15 μM CF-mal kezelt és DMSO-val kezelt paraziták. ( c ) 6,5 μM DA-val és Milli-Q vízzel (M-QW) kezelt paraziták. ( d ) 19,5 μM DA-val és M-QW-vel kezelt paraziták. A csillagok statisztikailag szignifikánsan jelzik (* P 14, 15). Feltételeztük, hogy a CF- vagy DA-kezeléssel kezelt és kezeletlen paraziták nukleáris, mitokondriális és apicolast gének mRNS-szintjeinek változása közötti különbségek összefüggést mutattak a DNS- A CF nem gátolja az RNS-polimerázt 8, és a CF és DA RNS-kötési aktivitása nem egyértelmű, ezért a qPCR assay segítségével megvizsgáltuk a CF- vagy DA és a kezeletlen paraziták közötti DNS-sejtmag, mitokondriális és apicoplasztikus gének mennyiségét. .
A DNS mennyiségi elemzéséhez a 4 és 15 μM CF-vel kezelt parazitákban a DNS extranukleáris gének mennyiségének változása dózisfüggő volt a DMSO-val kezelt parazitákhoz képest. a macskák génjei nem voltak kissé szabályozva (5a. és b. ábra). Ezenkívül a nukleáris gének DNS-mennyiségét nem szabályozták, míg az extranukleáris gének mennyisége 6,5 μM DA-val kezelt parazitákban csökkent az M-QW-vel kezelt parazitákhoz képest (5c. Ábra). A 19,5 μM DA-val kezelt paraziták esetében a nukleáris gének DNS-mennyiségének felfelé történő szabályozása volt megfigyelhető, míg a mitokondriális és az apicoplaszt géneknél a szabályozáshoz képest lefelé történő szabályozás volt megfigyelhető (5d. Ábra).
CF-vel vagy DA-val kezelt B. bovis-ban lévő DNS mennyisége. ( a ) 4 μM CF-kezelt és DMSO-val kezelt paraziták. ( b ) 15 μM CF-mal kezelt és DMSO-val kezelt paraziták. ( c ) 6,5 μM DA-val és Milli-Q vízzel (M-QW) kezelt paraziták. ( d ) 19,5 μM DA-val és M-QW-vel kezelt paraziták.
Teljes méretű kép
A qPCR eredmények arra utalnak, hogy a CF és DA megkötik az AT-ban gazdag mitokondriumokat és az apikolasztokat, hogy gátolják az extranukleáris gének mRNS- és DNS-bioszintézisét B. bovis-ban. Ezzel szemben a DA nem tudta gátolni az összes gén mRNS-bioszintézisét, valamint a CF és a DA nem lehet toxikus az mRNS-re és a nukleáris gének DNS-bioszintézisére.
Végül a CF-DA kombinációja additív hatást mutatott a B. bovis, B. bigemina és B. caballi in vitro növekedésére, valamint szinergikus hatásokat mutatott a T. equi és a kombinált kemoterápia alacsony dózisú CF és DA kezelésére. erősebb gátló hatása van a B mikrotákra egerekben, mint monokemoterápiájuk. A CF és DA hasonló hatásmódja, amely kötődik az AT-ban gazdag aktivitáshoz, arra utal, hogy ezek a gyógyszerek kombinációban hozzájárulhatnak a babéziai paraziták elleni együttműködéshez. Mindezek az eredmények arra utalnak, hogy a CF-DA kombinált kemoterápia jobb választás az állati piroplazmózis kezelésében a CF és DA monokemoterápiához képest. A B. bovis és a B. bigemina kombinált terápia hatékonyságának további értékelése szarvasmarháknál, valamint a B. caballi és T. equi lovaknál szükséges lesz e terápia jövőbeni alkalmazásához az állatok piroplazmózisával szemben. Ezenkívül a CF és atovaquone, azitromicin vagy klindamicin kombinációs terápiájának tanulmányozását kell előnyben részesíteni, amelyek jelenleg rendelkezésre állnak az emberi babeziózis kezelésére szolgáló gyógyszerek.
Anyagok és metódusok
Etikai nyilatkozat
Valamennyi állatkísérletet az állatkísérletek és az összes állat- és DNS-kísérlet irányítására és működtetésére vonatkozó előírásoknak megfelelően hajtották végre, amelyeket az állatok gondozásával és felhasználásával foglalkozó bizottság, valamint a kórokozók biológiai biztonsági bizottsága és az Obihiro Mezőgazdasági és Állatorvosi Egyetem jóváhagyott illetve Hokkaido, Japán (állatkísérleti belépési szám: 28–110/28–111; DNS-kísérlet: 201325-4/201321-4). Az ebben a vizsgálatban szereplő összes kísérletet az Japán Oktatási, Kulturális, Sport-, Tudományos és Technológiai Minisztérium hatáskörébe tartozó akadémiai kutatóintézetek állat-viselkedési és kapcsolódó tevékenységeinek alapvető irányelveivel összhangban hajtották végre.
Paraziták és állatok
A B. bovis, az argentin B. bigemina és az USDA B. caballi és T. equi törzsek in vitro tenyészeteit a fentiekben leírtak szerint tartottuk fent, 25, 26, 27 .
Az állatkísérleti modellhez B. microti és nyolc hetes nőstény BALB/c egerek müncheni törzsét (a CLEA Japan, Inc.-től, Tokió, Japán vásárolta) használták.
Vegyszerek és reagensek
Minden vegyi anyagot és reagenseket a Sigma-Aldrich-től (Tokió, Japán) vásároltak, kivéve a DA-t (Novartis Animal Health). A CF-t és a DA-t 10 mM-en oldottuk DMSO-ban és M-QW-ben törzsoldatként az in vitro gátlási vizsgálathoz. CF és DA oldószereket (DMSO és M-QW) alkalmaztunk a kontroll kultúrákban ugyanolyan koncentrációban, mint amennyi ezen gyógyszerek legnagyobb koncentrációjának előállításához használatos volt minden in vitro gátlási vizsgálatban. Az in vivo gátlási vizsgálathoz 10, 15 és 20 mg/kg CF-t és 10, 15 és 25 mg/kg DA-t oldottunk fel szezámolajban és autoklávozott sóoldatban (0,9% NaCl w/v, pH 7,2). közvetlenül a kezelés előtt.
In vitro CF-DA kombináció gátlási teszt
A CF - DA kombinációk kemoterápiás aktivitásának in vivo értékelése
Az in vivo gátlási vizsgálatot a fent leírtak szerint hajtottuk végre. Röviden: az egereknek (5/csoport) intraperitoneálisan 1 x 107 B-mikro-fertőzött vörösvértestet injektáltunk. A parazitémiát és a hematokritot 2 és 4 naponta követtük mikroszkóppal, valamint Celltac és MEK-6450 automatizált hematológiai analizátorral (Nihon Kohden Corporation, Tokió, Japán). Amikor minden egérben 1% feletti parazitémiát észleltünk, az I, II, III, IV és V csoportokat 0,2 ml szezámolajjal és sóoldattal kezeltük kezeletlen kontrollként, 0,2 ml szezámolajjal és 25 m/kg DA, 20 mg ./kg CF és 0,2 ml sóoldat, 15 mg/kg CF és 10 mg/kg DA és 10 mg/kg CF és 15 mg/kg DA. CF-t és szezámolajat, valamint DA-t és sóoldatot orálisan és intraperitoneálisan adtunk be, egymást követő öt napon keresztül. A parazitaemiát úgy határoztuk meg, hogy a fertőzött vörösvértesteket 2000 vörösvértestbe számoltuk, kétnaponta előkészített Giemsa-festett vékony vérkeneteket használva, amíg egyetlen egérben sem találtunk parazitát. A kísérletet háromszor megismételtük.
A kezelt B. microti PCR kimutatása és fertőzőképessége
Az in vivo gátlási vizsgálatot követően az összes egeret érzéstelenítettük, majd a vért (szívpunkcióval összegyűjtöttük), az agy-, a szív-, a lép-, a vese- és a májszöveteket összegyűjtöttük és DNS-extrakcióhoz használtuk. A PCR-vizsgálatot a fent leírt 6. eljárás alkalmazásával hajtottuk végre .
Az I – V csoport 1 × 108 eritrocitáját 5 új egércsoportba (3/csoport) transzfektáltuk intraperitoneális injekcióval. A parazitémiát Giemsa-festett vékony vérkenetekkel követtük nyomon, háromnaponta, 36 napig.
Kétnapos gátlási teszt és korai morfológiai változások, valamint CF-vel vagy DA-val kezelt B. bovis fejlődése
Kilencven mikroliter GIT táptalaj, amely 0, 1, 0, 5, 1, 1, 5, 2, 2, 5, 3 és 4 μM vagy DA 0, 01, 0, 05, 0, 1, 0, 25,0, 5, 1 és 2 μM, 0,04% DMSO-t vagy 0,08% M-QW-t adtunk egy 96 lyukú tenyészlemezhez három példányban. 10 mikroliter 1% parazitizált vörösvértestet (10% hematokrit) adtunk minden egyes lyukba 27,29. A tenyészeteket 2 napig inkubáltuk, és a tápközeget a gyógyszerekkel és a kontrollokkal a tenyészetek 0. és 1. napján megváltoztattuk. Az IC25, IC50 és IC75 értékeket a mikroszkóp tenyésztés és a fluoreszcencia alapú vizsgálat 2. napján külön-külön határoztuk meg, a fent leírtak szerint, kis módosítással 27,29. A kísérletet háromszor megismételtük.
A CF vagy DA kezelt B. bovis paraziták morfológiai változásait 0, 5, 1, 2, 4, 6, 8, 12, 24, 36 és 48 órakor figyeltük meg a vörösvértest falain mikroszkóppal. Az intraeritrocita parazita páros és egysejtű stádiumát 400 iRBC-ben figyeltük meg Giemsa festéssel. A tenyészetet az előző módszerrel végeztük, kevés módosítással: 900 μl CF-t vagy DA-t tartalmazó GIT táptalajt IC25, IC50 és IC75 végkoncentrációban, 0,02% DMSO-t vagy 0,03% M-QW-t adtunk a 24 lyukú tenyésztőlemezre. három példány. Minden üregbe 100 μl 1% parazitált vörösvértestet (10% hematokrit) adtunk. A gyógyszerekkel és a kontrollokkal ellátott táptalajt a tenyésztés 0. és 24. órájában megváltoztattuk.
Egynapos gátlási teszt és mRNS és DNS mennyiségi meghatározása CF-vel vagy DA-val kezelt B. bovis-ban
A B. bovis elleni IC50 és IC 75 CF és DA értékeket minden egyes gyógyszer 8 különböző koncentrációjával és a kontroll (0,4% DMSO vagy 0,2% M-QW) alkalmazásával három példányban határoztuk meg. Kilencven mikroliter GIT tápközeget (szérummentes) gyógyszerek és kontrollok nélkül, valamint 10 μl 1% parazitált eritrocitát (10% hematokrit) adtunk egy 96 lyukú tenyésztőlemezre a tenyészetek 0. napján a fent leírtak szerint, kevés módosítással 27 . Az 1. napon 90 μl GIT táptalajt CF-vel helyettesítettünk GIT táptalajjal (végső koncentrációban: 0, 5, 1, 2, 3, 4, 10, 20 és 40 μM), DA-val (végső koncentrációkon: 0, 1, 1, 2, 4, 6, 8, 10 és 20 μM) vagy kontrollok. Az IC50 és IC75 értékeket a tenyészet 2. napján határoztuk meg mikroszkóppal, Giemsa-festett vörösvérsejt festékkel. A kísérletet háromszor megismételtük.
Az RNS és a DNS megszerzéséhez a tenyésztést 1 napos gátlási vizsgálattal végeztük 2000 μl tenyészetekkel, 12 üreges tenyésztőlemezen, amely 1800 μl GIT táptalajt és 200 μl iRBC-t tartalmazott. Ezernyolcszáz mikroliter GIT táptalajt helyettesítettünk azonos térfogatú CF vagy DA tartalmú GIT táptalajjal IC50-nél és IC75-nél vagy kontrolloknál (végső koncentrációban: 0,15% DMSO és 0,195% M-QW) a tenyészetek 1. napján. A fertőzött vörösvértesteket a tenyészetek 2. napján gyűjtöttük be.
Az RNS-t és a DNS-t 200 μl iRBC-ből extraháltuk TRIzol reagenssel (Invitrogen, CA, USA) vagy QIAamp DNS Blood Mini kit (QIAGEN, Tokió, Japán) RNase A emésztéssel (Takara Bio Inc., Otsu, Japán). a gyártó utasításainak megfelelően. Az RNS-t QIAamp RNS Isolation Blood Mini készlettel (QIAGEN, Tokió, Japán) tisztítottuk rekombináns DNáz I emésztéssel (Takara Bio Inc., Otsu, Japán), majd cDNS szintézisnek vetettük alá Random Hexamers primer (Takara Bio Inc., Otsu, Japán). Japán). A specifikus primereket (S2 táblázat) magok (18S rRNS, tubulin béta lánc és Arm/cat; GenBank belépési számok: L19077, XM_001611566 és XM_001612062), mitokondriális (cob és cox3; GenBank belépési szám: AB499088) és szekvenciák felhasználásával terveztük meg. apicoplasztok (tufA és clpC; GenBank: NC_011395) Primer Express® szoftverrel (Life Technologies, Thermo Fisher Scientific). A qPCR vizsgálatot Master SYBR® Green PCR Master Mix (Applied Biosystems, Warrington, Egyesült Királyság) segítségével végeztük. A célgének ismételt változását a 18S rRNS-hez képest CF-vel vagy DA-val kezelt és DMSO-val vagy M-QW-vel kezelt B. bovis-ban határoztuk meg a fentiek szerint. .
Statisztikai elemzés és ICFIC képlet
A szórást 3 egyedi kísérletben számoltuk ki, és statisztikailag szignifikáns különbség volt (P 1, 2 és 4 szignifikáns antagonizmust jelez, a fentiek szerint 18 .
A FIC index becslése a következő képleten alapul:
A qPCR-ben a kezeletlen vagy kezelt csoportok 3 egymástól függetlenül tenyésztett tenyészetén belül kiszámítottuk a szórásokat, és mindegyik ciklust megismételtük a korábban leírt módszer és a statisztikai elemzés elve szerint 30, 31 .
köszönöm
Ezt a munkát anyagilag támogatta az Országos Protozoonai Betegségek Kutatóközpontja, az Obihiro Mezőgazdasági és Állatorvostudományi Egyetem kooperatív kutatási támogatása (28-joint-4).
Elektronikus kiegészítő anyag
További információ
Hozzászólások
Megjegyzés beküldésével vállalja, hogy betartja Általános Szerződési Feltételeinket és közösségi irányelveinket. Ha ezt sértő cselekedetnek találja, amely nem felel meg feltételeinknek vagy irányelveinknek, kérjük, jelölje meg nem megfelelőnek.
- Bhringaraja természetes hajnövekedés Ayurveda hajhullás elleni gyógyszer
- Pronamel Whitening fehérítő fogkrém 75 ml - Az egészség természetes útja
- A Denník N harcolások ellen harcol Mi már repültünk a szerkesztőségben, mondja a szerkesztő - Néha Nečas
- Cellulit elleni gyakorlatok
- Biofagy izom-, ízületi és hátfájás esetén - GYÓGYSZERÉSZETI ORVOS
