elemeket
absztrakt
Az alkoholmentes zsírmájbetegség (NAFLD) az egyik leggyakoribb májbetegség, de mögöttes mechanizmusát rosszul ismerik. Itt megmutattuk, hogy a májban dúsított 4a májfaktor (HNF4a), a májban dúsított nukleáris hormon receptor, jelentősen gátolt, míg a miR-34a erősen indukálódik alkoholmentes steatohepatitisben szenvedő betegeknél, cukorbeteg egereknél és magas zsírtartalmú táplálékkal rendelkező egereknél. diéta. A miR-34a nélkülözhetetlen a HNF4a expresszióhoz, és szabályozza a triglicerid felhalmozódását az emberi és az egér hepatocitákban. A miR-34a gátolja a nagyon kis sűrűségű lipoproteinek szekrécióját, és HNF4a-függő módon elősegíti a máj steatosisát és hipolipidémiáját. Ennek eredményeként a megnövekedett miR-34a expresszió vagy a májban csökkent HNF4a expresszió gyengíti az érelmeszesedés kialakulását Apoe -/- vagy Ldlr -/- egerekben. Ezek az adatok azt mutatják, hogy a miR-34a-HNF4a út normál metabolikus stressz esetén aktiválódik, és szerepet játszhat a NAFLD patogenezisében és a plazma lipoprotein metabolizmus szabályozásában. Ennek az útnak a fókuszálása új megközelítést jelenthet a NAFLD kezelésében.
Az elhízás, a cukorbetegség és az inzulinrezisztencia az alkoholmentes zsírmájbetegség (NAFLD) 1, 2, 3 általános kockázati tényezője, világszerte az egyik leggyakoribb májbetegség. Az Egyesült Államokban a lakosság legfeljebb 25% -ának NAFLD-értéke 4, 5. A NAFLD az egyszerű steatosisból indul ki, amely többszörös "találatok" után alkoholmentes steatohepatitiszé (NASH) válhat, beleértve a gyulladásos mediátorokat, a reaktív oxigéneket (ROS) és hasonlókat, 4, 6, 7. A NASH májcirrhosissá és hepatocelluláris carcinomává válhat. A mai napig a NAFLD patogenezisének hátterében álló mechanizmus még kevéssé ismert. A NAFLD jelenlegi kezelése ezért csak a társult szindrómák, például a cukorbetegség és az elhízás kezelésére korlátozódik 8, 9 .
A 4a hepatocita nukleáris faktor (HNF4a) egy nukleáris hormon receptor, amely fontos szerepet játszik mind a felnőttek fejlődésében, mind fiziológiájában. Magasan expresszálódik a májban, alacsonyabb a vese, a bél és a hasnyálmirigy β-sejtjeinek 10, 11 szintje. A HNF4a erősen konzervált DNS-kötő doménnel és ligandumkötő doménnel rendelkezik. A HNF4a szerkezeti elemzése azt sugallja, hogy a C14 - C18 hosszú láncú zsírsavak szorosan kötődnek a HNF4a hidrofób kapszulájához, és nem denaturálhatók a denaturáló körülmények között, 12, 13. Mint ilyen, a HNF4a konstitutívan aktív.
A HNF4a szabályozza az epesavak, lipidek, glükóz és gyógyszerek metabolizmusában szerepet játszó sok gén alap expresszióját. A funkcióvesztés mutációi az emberi HNF4α-ban 1-es típusú (MODY1) cukorbetegséget okoznak érettséggel, autoszomális domináns öröklődéssel, korán megjelenő cukorbetegséggel és hasnyálmirigy β-sejtek diszfunkciójával jellemezhetők14. Úgy tűnik, hogy a cukorbetegség fenotípusa a hasnyálmirigyben csökkent glükózstimulált inzulinszekrécióból ered 15. A diabétesz fenotípus mellett a MODY1-ben szenvedő betegek csökkentették a plazma trigliceridek (TG) és a koleszterinszint 16, 17, 18 értékét, feltehetően a nagyon alacsony lipoprotein-sűrűség (VLDL) szekréciójának károsodása miatt a májban 19. A csökkent VLDL szekrécióval összhangban mi és mások megmutattuk, hogy a máj HNF4α elvesztése zsírmájat és hypolipidaemiát eredményez az egerekben 19, 20 .
A mikroRNS-ek (miRNS-ek) kicsi, nem kódoló RNS-molekulák, amelyek az mRNS 3'-nem-transzlált régiójához (3'UTR) történő transzkripciós kötődést követően szabályozzák a génexpressziót. A miRNS-ekről kiderült, hogy a sejtproliferáció, a gyulladás és az anyagcsere fontos szabályozói. A legújabb tanulmányok kimutatták, hogy a máj miRNS-einek jelentős hatása lehet a lipid- és lipoprotein-anyagcserére 21, 22, 23 .
Ebben a jelentésben megvizsgáljuk a miR-34a-HNF4α út szerepét az emberi NAFLD patogenezisében, valamint a plazma lipidek és lipoproteinek metabolizmusában. Adataink azt mutatják, hogy ez az út mind a NASH betegeknél, mind a cukorbetegeknél vagy a magas zsírtartalmú (HFD) egereknél aktiválódik. Ezután megvizsgáljuk, hogy ez az út szabályozza-e a máj és a plazma lipidek és/vagy lipoproteinek metabolizmusát. Végül megvizsgáljuk, hogy mely metabolikus ingerek váltják ki ennek az útnak az aktiválódását. Adataink azt sugallják, hogy a miR-34a-HNF4a útvonal vonzó célpont lehet az emberi NAFLD kezelésében.
az eredmény
A HNF4a és miR-34a expresszió inverz szabályozása in vivo
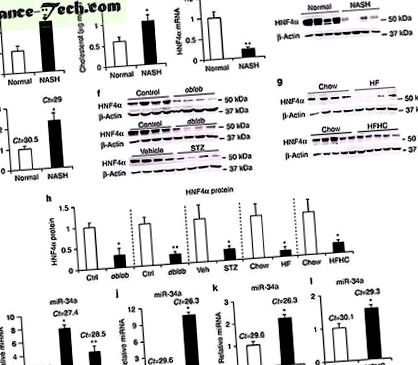
Mi és mások korábban kimutattuk, hogy a máj HNF4α elvesztése 19, 20 zsírt okoz egerekben. Mivel a HNF4α nagyon konzervált az emberek és a rágcsálók körében, megvizsgáltuk a HNF4α szerepét az emberi NAFLD kialakulásában. A normál alanyokhoz képest a NASH-betegek máj TG-értéke (1a. Ábra) és koleszterinszintje (1b. Ábra) megemelkedett. Nevezetesen a máj HNF4a mRNS szintje 80% -kal csökkent (1c. Ábra), és a HNF4a fehérje szintje szinte nem volt kimutatható (1d. Ábra és 1a. Kiegészítő ábra) a NASH betegeknél. A máj HNF4α expressziójának jelentős csökkenésével összhangban a HNF4α célgének száma szintén jelentősen csökkent a NASH-ban szenvedő betegeknél (1. kiegészítő táblázat). Kimutatták, hogy a MiRNA-k szerepet játszanak a NAFLD 24, 25 fejlesztésében. A NASH betegek májában a miR-34a (1e. Ábra), de nem a miR-19b vagy miR-27b (kiegészítő 1b. Ábra)> 2-szeres.
Annak megértése érdekében, hogy a miR-34a hogyan szabályozza a HNF4a expressziót, megvizsgáltuk, hogy a miR-34a kötődik-e a HNF4a 3'UTR-jéhez. Két erősen konzervált miR-34a kötőhely van mind az emberi, mind az egér 3'UTR HNF4a-ban (további 8a. Ábra, b). Amint az a 2. ábrán látható. A 3i. Ábrán a miR-34a mimetikum jelentősen elnyomta a Hnf4a3'UTR-hez kötött luciferáz promoter aktivitását, és ez a represszió megszűnt, amikor a második miR-34a kötőhely (mutB) mutálódott. Az in vitro adatok megerősítésére a Hnf4a kódoló régiót, valamint a vad típusú vagy mutáns 3′UTR-t túlexpresszáltuk máj-specifikus Hnf4a -/- egerekben. A miR-34a túlzott expressziója szignifikánsan csökkentette a HNF4a fehérje exogén szintjét, amikor a Hnf4a kódoló régió a vad típusú 3'UTR-hez vagy a 3'UTR-hez kapcsolódott az első miR-34a (mutA) kötőhely mutációival, és ez a redukció megszűnt, amikor a kódoló Hnf4a régiót 3 toUTR-re fuzionáltuk mutB-vel (3j ábra). Így in vitro és in vivo adataink azt mutatják, hogy a miR-34a gátolja a Hnf4a expresszióját a második 3'UTR kötőhelyhez való kötődés révén.
A HNF4α szabályozza az aterogenezist és az energia-anyagcserét
A funkcionális mutációk elvesztése a HNF4α-ban hypolipidaemiát okoz a MODY-ban szenvedő betegeknél. Egyelőre nem tudni, hogy a MODY1-ben szenvedő betegek védenek-e az érelmeszesedéssel szemben. Mivel a máj HNF4α jelentősen csökken a különböző metabolikus stresszek alatt (1. ábra), megvizsgáltuk a máj HNF4α akut és krónikus veszteségének hatását az érelmeszesedés kialakulására. A máj Hnf4a akut leütése shRNS-sel Apoe -/- egerekben 3 hétig az összes koleszterin plazmaszintjének> 50% -os csökkenését és a plazma TG% 30% -os csökkenését okozta a nyugati étrendben (9a-c. Kiegészítő ábra). A plazma lipoprotein profilok elemzése flash protein folyadékkromatográfiával (FPLC) azt mutatta, hogy a máj Hnf4a elvesztése csökkentette a plazma VLDL-koleszterin- és LDL-koleszterinszintjét (4a. Ábra) és a VLDL TG-t (4b. Ábra). A plazma lipidek és lipoproteinek változásával összhangban a máj Hnf4α akut leütése Apoe -/- egerekben> 50% -kal csökkentette az aorta elváltozás méretét (4c. Ábra és Kiegészítő 9d. Ábra). Ezenkívül a máj Hnf4a elvesztése Apoe -/- egerekben fokozta a TG felhalmozódását a májban (4d. Ábra), és csökkentette az MTP és ApoB fehérje expresszióját (9e. Kiegészítő ábra). Ezek az adatok azt mutatják, hogy a máj HNF4α akut vesztesége csökkenti az atherosclerosis kialakulását Apoában -/- .
A máj miR-34a gátolja az aterogenezist az Ldlr -/egerekben -
Az a megállapítás, hogy a miR-34a a HNF4α gátlásán keresztül szabályozza a lipid anyagcserét (3. ábra), arra késztetett bennünket, hogy megkérdezzük, vajon a miR-34a szabályozza-e az érelmeszesedés kialakulását. A miR-34a túlexpressziója Ldlr -/- egerekben, amelyet nyugati étrenddel tápláltak, csökkentette az összes plazma koleszterinszintet (5a. Ábra) és a TG szintet (5b. Ábra). Az FPLC elemzés adatai azt mutatták, hogy a miR-34a csökkentette a VLDL és az LDL koleszterinszintjét (5.c ábra), valamint a VLDL TG-t (5d. Ábra). Ennek eredményeként a miR-34a májban történő túlzott expressziója az Ldlr -/- egerek mindkét aorta gyökerében (5e. F) és az aortájában (5g, h)> 50% -kal csökkentette az érelmeszesedés mértékét. A májban a miR-34a túlzott expressziója Ldlr -/- egerekben gátolta a HNF4a, ApoB100 és ApoB48 máj expresszióját (5i. Ábra) és a máj TG szintjének növekedését (11. kiegészítő ábra). Így akár a máj miR-34a túlzott expressziója (5. ábra), akár a máj HNF4a gátlása (4. ábra) védelmet nyújthat az érelmeszesedés kialakulása ellen.
80%. Ennek eredményeként az ismert Hnf4a célgének némelyike redukálódik, míg mások ezekben az egerekben változatlanok maradnak (2. kiegészítő táblázat). Más szelektív faktorok is hozzájárulhatnak a HNF4a célgének szelektív szabályozásához HFD-vel táplált egerekben.
Choi és mtsai. 38 kimondja, hogy a miR-34a csökkenti a NAD + szintet és a SIRT1 aktivitást azáltal, hogy a NAMPT-t, a NAD + szintézis sebességkorlátozó enzimét célozza meg. Bár ismert, hogy a SIRT1 fontos szerepet játszik az anyagcsere szabályozásában, beleértve a máj TG metabolizmusát is, még meg kell határozni, hogy a SIRT1 szerepet játszik-e a miR-34a által szabályozott TG metabolizmusban. Meggyőző adataink szerint a miR-34a növeli a máj TG-szintjét a HNF4a gátlásával. Érdekes módon a miR-34a túlzott expressziója szelektíven szabályozza néhány HNF4a célgént (3. ábra), ami a HNF4a expresszió hiányos gátlásának és a HNF4a-független génszabályozásnak az eredménye lehet.
A tanulmány másik fontos megállapítása, hogy bebizonyítjuk, hogy a miR-34a-HNF4a útvonal szabályozza az ApoB plazmatartalmú lipoproteinek metabolizmusát és az érelmeszesedés kialakulását is. Az ApoB-tartalmú lipoproteinek emelkedett plazmaszintjei felgyorsítják az érelmeszesedés kialakulását. Adataink azt mutatják, hogy a miR-34a-HNF4a útvonal elősegíti a hipolipidémiát a VLDL szekréciójának gátlásával. Ennek a megállapításnak megfelelően a NASH-ban szenvedő betegekről beszámoltak arról, hogy csökkent a VLDL szekréciója 39. A hypolipidaemia miatt a miR-34a túlzott expressziója vagy a máj Hnf4a expressziójának gátlása/ablációja megakadályozza az ateroszklerózis kialakulását Apoe -/- vagy Ldlr -/- egerekben. Ezek az adatok szolgáltatják az első bizonyítékot arra, hogy a miR-34a-HNF4a út szabályozza az érelmeszesedés kialakulását. Vizsgálataink alapján érdekes lesz megállapítani, hogy a NASH-ban szenvedő betegek és/vagy a MODY1-es betegek védettek-e az érelmeszesedéstől.
Amellett, hogy tisztáztuk a miR-34a-HNF4α útvonal szerepét a lipid- és lipoprotein-anyagcsere szabályozásában, azt is megvizsgáltuk, hogyan aktiválódik ez az út normális metabolikus stressz esetén. Adataink arra utalnak, hogy a miR-34a-HNF4a útvonal aktiválódik mind a p53-függő, mind a p53-független módszerekben (6.j ábra). NASH-ban szenvedő betegeknél a p53, az FFA és a koleszterin együttműködhet a miR-34a-HNF4a út aktiválásában. A p53 azonban nem aktiválódik HFD által kiváltott cukorbetegség vagy elhízás esetén. Így utóbbi körülmények között az FFA és a koleszterin lehet a miR-34a-HNF4a út aktiválódását kiváltó fő tényező. Egyik jövőbeni irányunk az lesz, hogy megvizsgáljuk, hogyan aktiválja az FFA és a koleszterin a miR-34a-HNF4α útvonalat, és hogy más metabolikus ingerek vesznek-e részt ennek az útnak a szabályozásában.
Összefoglalva, a jelen tanulmány kimutatta, hogy a miR-34a-HNF4a útján indukálható metabolikus út kritikus szerepet játszhat a NAFLD patogenezisében, valamint a plazma lipid- és lipoprotein-metabolizmusának szabályozásában. Noha a máj HNF4α elvesztése jótékony hatással van az érelmeszesedésre és az energia homeosztázisra, a máj HNF4α elvesztése a VLDL szekréciójának gátlásával zsírmájat okoz. Tehát terápiás szempontból a máj HNF4a expressziójának elnyomása, valamint a máj steatosisát enyhítő megközelítésekkel együtt hasznos lehet az érelmeszesedés kialakulásának megakadályozásában. Ezzel szemben a máj HNF4α túlzott expressziójának nincs nagy hatása a plazma lipid- vagy lipoprotein-anyagcserére, mivel a HNF4α az egyik leggyakoribb gén a májban 19. Mivel a HNF4α expressziója jelentősen csökken a metabolikus stresszben (cukorbetegség, HFD és NASH táplálás), a HNF4α adeno-asszociált víruson vagy más génterápiás hordozón keresztül történő szállítása életképes és vonzó megközelítés az anyagcserével összefüggő NAFLD megelőzésében és kezelésében. stressz. szindróma. A máj működésének antagonizmusa a miR-34a antagomir által szintén megvalósítható megközelítés, amely segíthet megakadályozni a NAFLD kialakulását. Így a miR-34a-HNF4a útvonal célzása ígéretes és vonzó megközelítést jelent az emberi NAFLD kezelésében.
mód
Emberi szövetek, máj, egér és diéta
Mutagenezis, transzfekciók és sejttenyészet
adenovírusok
Az Ad-shLacZ, Ad-HNF4a, Ad-shHNF4a, Ad-empty (kontroll) és Ad-miR-34a korábban már leírták 19, 35. Az Ad-HNF4a felépítésénél csak a Hnf4a kódoló régiót (amely nem tartalmaz 3'UTR-t) klónoztunk az adenovirális vektorba. Ezzel szemben az Ad-HNF4a-3'UTR, Ad-HNF4a-3'UTR_mutA és Ad-HNF4a-3'UTR_mutB a Hnf4a kódoló régió plusz a vad típusú vagy mutáns 3'UTR klónozásával jött létre (mutA vagy mutB segítségével). pAd/CMV/V5-Dest vektorba (V493-20 katalógus, Life Technologies), majd transzfektáljuk 293 sejtbe az adenovírus 40 előállításához. Az Ad-p53-at a Vector Biolabs cégtől szereztük be (kat. Sz. 1168). Az Ad-anti-miR-34a-t Applied Biological Materials (British Columbia, Kanada) felhasználásával állítottuk elő. A sejteket adenovírusokkal fertőztük meg, többszörös fertőzéssel (MOI) 5-tel. Az egereket intravénásán (iv) injektáltuk 0,5-1,5x109 pfu adenovírussal. Hacsak másként nem jelezzük, az egereket 7 nappal a fertőzés után feláldoztuk.
Valós idejű PCR
Az RNS-t TRIzol Reagens (Life Technologies, CA) alkalmazásával izoláltuk. A miRNS-eket a mirVana miRNS izolációs készlet (Life Technologies, CA) segítségével izoláltuk. Az MRNS szinteket kvantitatív reverz transzkripciós polimeráz láncreakcióval (qRT-PCR) határoztuk meg az Applied Biosystems (Foster City, CA) 7500 valós idejű PCR gépén, SYBR Green Supermix (Roche, Indianapolis, IN) alkalmazásával. Az eredményeket Ct értékek felhasználásával számoltuk, és normalizáltuk a 36B4 mRNS szintre. A MiRNS-szinteket TaqMan primerek és próbák segítségével számszerűsítettük (katalógus 4427975, Life Technologies, CA), és U6 szintre normalizáltuk.
Northern blot mikroRNS vizsgálatok
A mikroRNS-szinteket Northern blot-vizsgálatokkal is meghatároztuk a gyártó utasításai szerint (Signosis, Santa Clara, CA. Cat # NB-1001). Az Northern blot analízisekben a miR-34a (MP-0602 katalógus) és az U6 (MP-0512 katalógus) ruhái szintén a Signose cégtől származnak.
MTP aktivitási vizsgálatok
A májat homogenizáltuk és az MTP-aktivitást a gyártó utasításai szerint mértük (Chylos, Inc., Woodbury, NY. Cat # R100).
Western blot tesztek
Western-blot vizsgálatokat teljes májlizátumok 41 vagy májminták magfehérjék alkalmazásával végeztünk, és a képeket ImageQuant LAS 4000 (GE Healthcare, Pittsburgh, PA) 42 alkalmazásával gyűjtöttük össze. Az MTP antitestet (sc-135994 katalógus), a HNF4a antitestet (sc-6556 katalógus) és a p53 antitestet (sc-6243 katalógus) a Santa Cruz Biotechnology-tól (Santa Cruz, Kalifornia) vásároltuk. Az ApoB antitestet a Meridian Life Science-től (K45253G, TN) szereztük be. A β-aktin antitest a Novus Biologicals cégtől származik (NB600-501, CO katalógus). A hiszton antitest a Cell Signaling cégtől (Beverly, MA) származott. Az antitesteket 1 μg ml-1 koncentrációban alkalmaztuk .
Antagomirok
miR-34a LNA inhibitort/antagomirt (LNA-miR-34a; anta-miR-34a; anta-34a) és miRNS scramble LNA inhibitor/antagomirt (LNA-scr; anta-scr) Exiqon (Dánia, Cat # 199900) szintetizált ). ob/ob egereknek vagy HFD-vel táplált egereknek (12 hétig HF-diétával táplálták) intravénásán injekciózták vagy anta-miR-34a, vagy anta-scr-t 6 naponta egyszer (10 mg kg-1). Három injekció után az egereket feláldoztuk.
A lipidek és lipoproteinek elemzése
Körülbelül 100 mg májat homogenizáltunk metanolban, és a lipideket kloroform/metanol (2: 1 v/v) eleggyel extraháltuk a leírtak szerint. A máj triglicerid- és koleszterinszintjét ezután a Thermo Scientific (Waltham, MA) Infinity reagenseivel számszerűsítettük. A plazma lipid- és glükózszinteket szintén meghatároztuk Infinity reagensekkel. A plazma lipoprotein profilt FPLC-vel elemeztük a 19. fejezetben leírtak szerint. Röviden, 100 μl plazma befecskendezése után a lipoproteineket 0,5 ml min-1 sebességgel 0,15 M NaCl, 0,01 M Na 2 HPO 4, 0,1 mM EDTA, pH 7,5 tartalmú pufferben futtattuk és Superose 6 10/300-on elválasztottuk. GL. oszlopot (GE Healthcare) a BioLogic DuoFlow QuadTec 10 rendszer (Bio-Rad, Kalifornia) segítségével. Frakciónként ötszáz mikroliter mintát gyűjtöttünk.
VLDL szekréció
A C57BL/6J egereket intravénásán specifikus adenovírusokkal injektáltuk. A 6. napon ezeket az egereket egy éjszakán át éheztettük, majd Tyloxapol (500 mg kg-1) intravénás injekciót adott. Vért vettünk a megadott időpontokban, és meghatároztuk a plazma TG-szinteket.
Az új lipogenezistől
Az egereknek ip-be nehéz vizet (2 H20) injektáltunk, hogy elérjük a 3% -os dúsulást. 4 óra elteltével a májat összegyűjtöttük. A jelzett és nem jelzett palmitátot, a glicerint (triglicerideket) és a koleszterint tömegspektrometriával elemeztük 19, 44 .
Ateroszklerotikus elváltozások
Az aortát és az aortagyökeret izoláltuk és boncoltuk. Az aorta gyökerét foszfáttal pufferolt sóoldattal mostuk, az optimális vágási hőmérsékletű vegyületbe ágyazottuk, majd szárazjégen lefagyasztottuk. A kamra középső részétől az aortaívig terjedő, 7 μm vastagságú kriozektációkat szuperfrost plusz mikroszkóp tárgylemezekre gyűjtöttük (12-550-15. Katalógus, Fisher Scientific). Az aorta szelepektől kezdődő régióban minden más szakaszt összegyűjtöttünk. A metszett aortagyökeret vagy az arcon lévő aortát olajvörös O-val festettük, és az ateroszklerotikus elváltozás méretét Image-Pro Premier 9.0 alkalmazásával határoztuk meg (Media Cybernetics, Rockville, MD) 45 .
Energia kiadások
A nyugati táplálékkal etetett egereket az átfogó laboratóriumi állatfigyelő rendszerbe (CLAMS) helyeztük. Meghatározták az oxigénfogyasztást, a CO 2 -termelést és a hőtermelést 46. Röviden: az egereket 40–48 órára az akklimatizációs ketrecekbe tették. Az akklimatizációs periódus után az egereket lemértük, és előre lemért táplálékkal visszahelyeztük az akklimatizációs ketrecbe. Az egerekben 30 másodpercenként mértük a gázcserét. A szobaleveget 0,472–0,600 liter/perc sebességgel (LPM) szivattyúzták az egér kalorimetriás ketrecébe, és a ketrec levegőjét 0,4 LPM-mel vették mintába. A fizikai aktivitást egyidejűleg mértük 16 infravörös érzékelővel 19 cm-en elosztva. Az elemzéshez az 1. nap déli és a 2. nap déli (EST) adatait választottuk ki.
Statisztikai analízis
A statisztikai szignifikanciát párosítatlan kétoldalas Student-féle t-teszttel vagy ANOVA-val (GraphPad Prisim, CA) elemeztük. Valamennyi értéket átlag ± sem értékként fejezzük ki. A különbségeket statisztikailag szignifikánsnak tekintettük P-nél