- elemeket
- absztrakt
- bevezetés
- Betegek és módszerek
- betegek
- Transzplantációs terv
- A hatékonyság értékelése
- A transzplantációval kapcsolatos toxicitás értékelése
- biostatisztika
- az eredmény
- A beteg jellemzői
- Hatékonysági végpontok
- Toxicitás a paliferminekre
- A transzplantációval kapcsolatos toxicitás
- OS és EFS
- vita
elemeket
- Csontvelő-transzplantáció
- kemoterápia
- Emésztőrendszeri betegségek
- Vérképző őssejtek
absztrakt
A palifermint, egy rekombináns humán keratinocita növekedési faktort szokás beadni a mucositis megelőzésére az autológ transzplantáció után. A biztonságosságra és a hatékonyságra vonatkozó adatok korlátozottak az allogén hematopoietikus őssejt-transzplantációkban (allo-HSCT). Retrospektív vizsgálatot végeztünk 251 allo-HSCT-n átesett betegnél, akik közül 154 kapott perifláns palifermint. Valamennyi betegnél a palifermin szignifikánsan csökkentette a teljes parenterális táplálás (TPN, 13 vs 16 nap, P = 0,006) és a beteg által kontrollált fájdalomcsillapítás (PCA, 6 vs 10 nap, P = 0,023) átlagos napszámát, valamint a a kezdeti kórházi tartózkodás hossza (LOS, 32 vs 37 nap, P = 0,014). A palifermin hatása azonban csak azoknál a betegeknél volt szignifikáns, akik kemoterápiás kezelést kaptak a TBI alapján, de a BU nem. TBI-befogadóknál a palifermin csökkentette a TPN napok átlagos számát (13 és 17 nap, P 1). Bár a súlyosság a kondicionálási rendtől függően változhat, az allo-HSCT-vel összefüggő mukozitisz jelentős morbiditáshoz vezethet, beleértve az orális fájdalmat is, amely fájdalomcsillapításhoz, anorexiához kábítószereket igényel teljes parenterális táplálást (TPN) igényel, hosszan tartó kórházi tartózkodás és esetleg transzlokált nyálkahártya baktériumok okozta életveszélyes fertőzések 2, 3, 4
A keratinocita növekedési faktor egy 28 kDa-os endogén fehérje a fibroblaszt növekedési faktorok sorozatában, amely növekedési faktorként funkcionál az epithelsejtekben. A keratinocita növekedési faktor fontos szerepet játszik a sérülés utáni hámgyógyulásban. 6 A palifermin (Kepivance, svéd árva biovitrium) egy rekombináns humán keratinocita növekedési faktor, amely stabilabb, mint az endogén keratinocita növekedési faktor, aminek következtében 23 aminosavat eltávolítanak N-terminálisáról (termékinformáció). Az egérmodelleken végzett preklinikai adatok azt mutatták, hogy a palifermin beadása véd a kemoterápia és a sugárzás által kiváltott mucositis ellen. 7, 8, 9, 10 A paliferminről klinikailag kimutatták, hogy enyhíti a mucositist kemoterápiát és TBI-alapú autológ HSCT-t követően. 11, 12 Az autológ transzplantált betegek III. Fázisú vizsgálata alapján, amely a TBI kondicionálása után az Egészségügyi Világszervezet III-IV fokozatú mucositisének csökkent előfordulását és időtartamát mutatta be, a Fif jóváhagyta a palifermint a mucositis megelőzésére autológ és allogén kezelés során. HSCT. A paliferminnel kapcsolatban az allo-HSCT-vel kapcsolatban azonban korlátozott számú tapasztalat áll rendelkezésre. 13, 14, 15
Annak eldöntése érdekében, hogy a palifermin biztonságos és hatékony-e az allo-HSCT után, retrospektív elemzést végeztünk a paliferminnel kapcsolatos tapasztalatainkról, amelyeket felnőtt betegeknél adtunk aloelo HSlat-nak myeloablatív T-sejt (TCD) kimerülésben hematológiai rosszindulatú daganatok esetén. A TCD beállítást választották a palifermin hatásainak tanulmányozására MTX hiányában, amelyet általában a GVHD megelőzésére használnak. Bár a TCD-t az Egyesült Államokban nem használják gyakran, több központ közelmúltbeli pozitív adatai támogatják a szélesebb körű felhasználást. 16, 17 Ez a tanulmány az eddigi legnagyobb publikált tapasztalatot mutatja be a palifermin allo-HSCT során történő alkalmazásával kapcsolatos részletekkel.
Betegek és módszerek
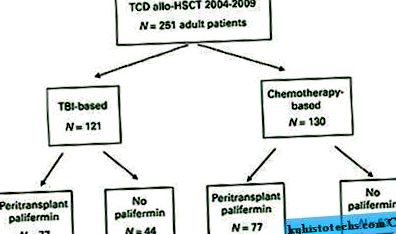
betegek
Teljes méretű kép
Transzplantációs terv
A T-sejteket a szójabab lektin szekvenciális agglutinálásával és a juh vörösvértestek kimerítésével távolítottuk el (kilenc beteg). A PBS-mobilizált G-CSF-ek 19 T-sejt-kimerülését a CD34 + őssejtek pozitív szelekciójával hajtottuk végre ISOLEX 300i mágneses szeparátor alkalmazásával, majd a juhok vörösvértest-rozettájának eltávolításával (231 beteg), 20 vagy CD34 + szár pozitív szelekciójával. sejteket Miltenyi CliniMACS rendszer alkalmazásával a juh juhvese-rozettájának későbbi kimerülése nélkül (11 beteg). A kemoterápia befejezése után 24-48 órán belül 16 csontvelő-kimerült T-sejtet vagy PBSC-t infundáltunk. A kondicionáló kezelések között 0-3 dózisú antitimocita globulin (ATG) volt. A GVHD farmakológiai profilaxisát nem biztosították, mivel a betegek teljesen ex vivo TCD-graftot kaptak.
A palifermint kapó betegek jóváhagyott adagolási rend szerint kapták a gyógyszert. Három napi adagot (60 mcg/kg/nap) adtak az átültetésre való felvétel előtt, a harmadik dózist legalább 24 órával a kemoterápia vagy a sugárterápia előtt. Az őssejt infúzió után 6 órával a betegek további három napi palifermin-dózist kaptak (60 mcg/kg/nap).
A hatékonyság értékelése
Adatokat gyűjtöttünk azokról a napokról, amikor a betegeknek szükségük volt TPN-re és beteg által kontrollált fájdalomcsillapításra (PCA) kábítószerekkel. 12, 14 A betegeket a kezelőorvos transzplantáció után PCA-ra helyezte, amikor a betegek a szájban vagy a torokban fájdalomra panaszkodtak, amely akadályozta a nyelést. A PCA-t abbahagyták, amikor a betegnek nem volt szüksége "szükséges dózisokra", alapdózis hiányában. A TPN kezelési folyamatunkat a fentiekben ismertettük. A befogadástól számított transzplantáció utáni kezdeti kórházi tartózkodás (LOS) hosszát szintén meghatároztuk minden betegnél.
A transzplantációval kapcsolatos toxicitás értékelése
A GVHD diagnózisát klinikai alapon állapították meg, és lehetőség szerint kórosan megerősítették. Az akut GVHD-t (aGVHD) a CIBMTR kritériumok szerint osztályoztuk. A transzplantációt követően 22 betegnél értékelhető volt az aGVHD. A krónikus GVHD (cGVHD) kiértékelhető volt olyan betegeknél, akik túlélték a 100 napot. A krónikus GVHD-t korlátozottnak vagy kiterjedtnek osztályozták a Sullivan-kritériumok szerint. A 23 NIH konszenzus kritériumot nem használták ebben a vizsgálatban, mert retrospektív jellegük korlátozta a cGVHD osztályozásához rendelkezésre álló adatokat.
Az elsődleges graftelégtelenséget a neutrofil helyreállítás hiányának (500500/μl) a 28. napra és a BM biopsziának határoztuk meg, amelynek cellularitása -5% volt. A másodlagos graft meghibásodást az ANC elvesztéseként határozták meg 18 évesen
biostatisztika
Összehasonlítottuk a PCA, a TPN és a LOS használatának folyamatos eredményeit a palifermin befogadók és a nem-receptorok között a t-teszt segítségével. A palifermin hatásának értékelésére a nyálkahártya-gyulladással összefüggő kimenetek mindegyikére lineáris regressziós modelleket állítottunk be az életkor, az ATG használata és az előkezelési rend (TBI és kemoterápia alapján) után. Bár az ATG használata várhatóan nem befolyásolta a mucositist, ezeket a többváltozós vizsgálatokba lefordították, hogy összhangban legyenek az aGVHD kialakulásáig eltelt idő elemzésével. Versenyképes kockázatelemzést és az életkor regresszió-szabályozásának, az ATG használatának és az előkezelésnek a többváltozós versenyképes kezelését alkalmazták a palifermin akut és krónikus GVHD-re gyakorolt hatásának értékelésére. Log-rank tesztet alkalmaztunk OS-n és EFS-en a palifermin túlélési eredményekre gyakorolt hatásának értékelésére. A Cox regressziós modellt alkalmaztuk ezekre a kimenetekre időről időre, életkor-beállítás, ATG-használat és előkészítési mód.
az eredmény
A beteg jellemzői
Az 1. táblázat részletesen leírja a beteg jellemzőit. A transzplantáció során a medián életkor 55 év volt (19-73 év közötti tartomány). A diagnózisok változatosak és az 1. táblázatban vannak részletezve. Összesen 121 beteg kapott TBI-alapú kondicionálást (48%, 1. ábra). Ezen betegek közül 77 (64%) kapott palifermint. A kemoterápia alapján allo-HSCT-ben részesült 130 beteg közül (52%) 77 (59%) palifermint kapott. Kilenc beteg kapott BM-t őssejtforrásként, a többi beteg pedig PBSC-graftot kapott. Összesen 213 beteg (85%) kapott ATG-t az őssejt-infúzió előtt, két beteg pedig ATG-t kapott az őssejt-infúzió után. Az ATG-t nem adták be további 36 betegnek, akik mind rokon donorok voltak, és akiket TBI, tiotepa és fludarabin (n = 34) vagy TBI, tiotepa és CY (n = 2) kezeltek. 20
Asztal teljes méretben
Két kivételével mind a betegek elérték a CD3 + sejtek kimerülési szintjét
a ) Az aGVHD kumulatív incidenciája minden paliferminben szenvedő felnőttnél. b ) A cGVHD kumulatív incidenciája minden paliferminben szenvedő felnőttnél.
Teljes méretű kép
OS és EFS
A medián 16, 3 hónapos követés (0, 03 - 75, 8 hónap közötti tartomány) esetén az OS medián értéke 53 hónap (95% CI: 32 hónap - nem érte el), és a medián EFS 39 hónap (95% CI: 25 hónap - nem érte el). A palifermin nem figyelt meg szignifikáns hatást OS-re (3a. Ábra) vagy EFS-re (3b. Ábra). A transzplantáció kora azonban szignifikáns prognosztikai tényező volt az OS (HR 1, 02, 95% CI: 1, 00–1, 04, P = 0,05) és az EFS (HR 1, 02, 95% CI: 1, 00– 1, 04, P = 0, 04), amely az ATG-t irányította. felhasználási és előkészítési rendszer.
a ) OS a palifermin alkalmazásakor. b ) EFS palifermint használva.
Teljes méretű kép
vita
Eredményeink az eddigi legnagyobb publikált tapasztalatot jelentik a paliferminnel kapcsolatban allo-HSCT-ben részesülőknél. A retrospektív vizsgálat korlátai miatt, ideértve az orvosok esetleges elfogultságát, először tudjuk bizonyítani, hogy a palifermin nem növeli a transzplantációval összefüggő toxicitást egy allogén transzplantációs környezetben, és hatékony a TBI-alapú allo-HSCT után. A palifermint allo-HSCT-vel értékelő korábbi vizsgálatok korlátozottak voltak, mert kisebb méretűek voltak, a GVHD megelőzésére irányultak, és/vagy nem használták a palifermint a jelenleg jóváhagyott adagolási rendben. 13, 14, 15
Vizsgálatunkban 154 allo-HSCT-n átesett beteg kapott periaran transzplantált palifermint. Mivel ez egy retrospektív vizsgálat volt, nem tudtuk pontosan beszámolni a palifermin hatásáról az Egészségügyi Világszervezet fokozatú mucositisére. A kifejezetten a mucositis felmérésére tervezett prospektív vizsgálatokon kívül az orvosi diagramban rögzített mucositis pontszám nem konzisztens. A korábbi, 12., 14., 15. vizsgálatokban ismertetett mukozitissel kapcsolatos klinikai végpontokat használtuk, és kimutattuk, hogy a TPN-használat, a PCA-használat és a tartózkodás hossza jelentősen csökkent. A TBI-alapú alo-HSCT-befogadók és a kemoterápia külön elemzésében a palifermin előnye a TBI-bejutókra korlátozódott. Ebben a betegcsoportban a palifermin 5 nappal (P = 0,033), a TPN-t pedig 4 nappal (P 12) csökkentette azoknak a napoknak az átlagos számát, akik PCA-t és TPN-t kaptak.
Vizsgálatunk azt is kimutatta, hogy a palifermin nem fokozta a transzplantációval kapcsolatos toxicitást az allo-HSCT során. Nem figyeltek meg nyilvánvaló növekedést az aGVHD és a cGVHD arányban vagy a graft meghibásodását ebben a nagy betegcsoportban, amely FDA által jóváhagyott palifermin adagot kapott. Mivel azonban minden beteg ex vivo és ATG TCD allograftot kapott, lehetséges, hogy a palifermin más körülmények között is befolyásolhatja a GVHD kialakulását. Továbbá nem volt különbség az OS vagy az EFS között a két csoport között (P = 0,74 és P = 0,463).
Korlátozott adatok állnak rendelkezésre a palifermin allogén transzplantáció során történő alkalmazásáról. 13., 14., 15. Blazar et al. 13 egy randomizált, placebo-kontrollos I/II fázisú vizsgálatot publikált, amelyben a palifermin hatását értékelték az aGVHD megelőzésére, preklinikai vizsgálatok alapján, amelyek arra utalnak, hogy a palifermin megakadályozhatja az aGVHD-t. 24, 25 Hatvankilenc beteg kapott palifermint, míg 31 beteg placebót. Adatainkkal összhangban nem volt különbség a két csoport között az aGVHD arányában, a graft időben, a relapszusban vagy a túlélésben. Az alcsoport-elemzés szignifikánsan csökkent incidenciát és közepes súlyosságú mucositist mutatott ki CY-ben és TBI-ben szenvedő betegeknél, de nem BU-val és CY-vel. Ez a vizsgálat négy különböző adagolási rendet tartalmazott, nyolc beteg kevesebb, 51 beteg pedig több palifermint kapott, mint a jelenlegi jóváhagyott adag. A vizsgálatban tíz beteg kapott palifermint az FDA által jóváhagyott egyidejű adagolás mellett.
Langner és mtsai. A 14. ábra a palifermin korlátozott sorozatát is mutatja az allo-HSCT környezetben. 30 olyan paliferminnel kezelt beteget kezeltek, akik leukémia miatt allo-HSCT-n estek át, és összehasonlították őket egy megfelelő történelmi kontrollcsoporttal. A palifermint kapó betegeknél a II-IV fokozatú mucositis előfordulása csökkent a kontrollokhoz képest (60% vs. 80%, P = 0,04). A paliferminnel kezelt betegeknél (6 vs 12 nap, P = 0,003) csökkent a mucositis átlagos időtartama, csökkent az átlagos beadott opioid dózis (150 mg vs. 378 mg, P = 0,04), és a TPN. (15 vs 26 nap, P = 0,002). Ebben a kis tanulmányban nem figyelték meg a palifermin hatását a hematológiai gyógyulásra, az aGVHD vagy OS kialakulására. Hasonlóképpen Nasilowska-Adamska et al. 15 kezelt 53 beteget hematológiai rosszindulatú daganatok miatt transzplantáltak paliferminnel, és összehasonlították őket a megfelelő korábbi kontroll csoporttal. Megerősítették a mucositis megelőzésének előnyeit, és az aGVHD kialakulásában nem volt különbség a csoportok között. A transzplantációra specifikus további allogén analízisek korlátozottak voltak, mert csak 24, paliferminnel kezelt beteg ment át allo-HSCT-n, míg a többi beteg autológ transzplantációban részesült.
Röviden, ebben a nagy retrospektív vizsgálatban bebizonyítottuk, hogy a palifermin hatékony az allo-HSCT alatt, és nem növeli a transzplantációval összefüggő toxicitást ebben a környezetben. Vizsgálatunk a jelzett dózissal kezelt betegek legnagyobb csoportját képviseli, és ezért jelentősen hozzájárul a jelenlegi klinikai gyakorlat irányításához az allo-HSCT-ben. Mivel a palifermin alkalmazása ebben a retrospektív vizsgálatban összetévesztésre kerül a HSCT dátumával és más klinikai tényezőkkel, ezen eredmények megerősítéséhez prospektív randomizált vizsgálatra van szükség. Jelenleg egy nagy, multicentrikus prospektív vizsgálatot tervezünk a palifermin biztonságosságának és hatékonyságának értékelésére TBI-alapú myeloablatív TCD allo-HSCT-s betegek populációjában, hogy megerősítsük eredményeinket.