elemeket
A krónikus limfocita leukémiát (CLL) a hosszú távú, érett, de nem funkcionális B limfociták vérben és primer limfoid szervekben történő felhalmozódása jellemzi. Ismeretes, hogy a leukémiás sejtek és a mikrokörnyezet kölcsönhatásai kritikus fontosságúak a CLL-sejtek in vivo túlélése szempontjából. A CLL sejtek hosszú ideig képesek túlélni in vivo, míg a sejtek in vitro gyorsan apoptózison mennek keresztül. Ez az in vitro megfigyelt spontán apoptózis és a CLL-sejtek gyógyszerérzékenysége erősen csökken a 2, 3, 4, 5 sztrómasejtek jelenlétében, amelyek elsősorban a közvetlen érintkezés révén stimulálják a CLL sejteket. Így az in vivo körülmények utánzása a CLL-rezisztenciában szerepet játszó mechanizmusok vizsgálatához megköveteli a kokulturális rendszerek felállítását. A mikroRNS-ek (miRNS-ek) a génexpresszió fontos szabályozói és hozzájárulnak a CLL patológiájához. 6, 7, 8 Nemrégiben a stromális sejteken végzett közvetlen tenyésztés után a CLR-sejtek miRNS-szintjének nagy változását írták le. 9, 10
Teljes méretű kép
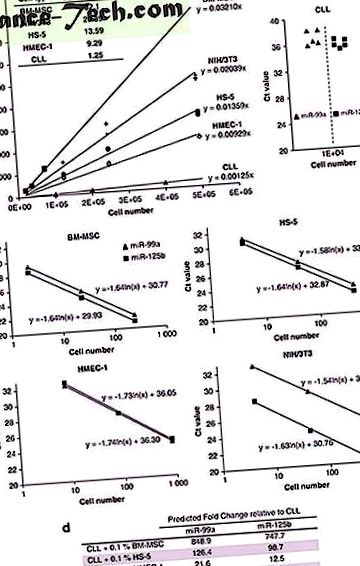
Eredményeink további megerősítése érdekében CLL-sejtek különböző kultúrájú stromális sejtekkel végzett kokulturális kísérleteit hajtottuk végre. A CLL sejteket 24 óra elteltével gyengéd pipettázással gyűjtöttük össze, hogy megkapjuk az összes CLL sejtet. Gondos mikroszkópos vizsgálat megerősítette a sztrómasejtek egyrétegének általános integritását. A kapott sejtek mikroRNS elemzése drámai növekedést mutatott a miR-99a és miR-125b szintekben (2a. Ábra), ami megerősítette Willimott és Wagner 9 által leírt eredményeket egér fibroblaszt sztrómasejtek alkalmazásával. Ezzel szemben az egér fibroblasztokon történő tenyésztés után a CLL-sejtekben jelentett miR-9 szint növekedését a BM-MSC vagy HMEC-1 sejteken történő tenyésztés után nem észlelték (az adatokat nem mutatjuk be). Érdekes, hogy a miR-9 nem volt kimutatható a BM-MSC és a HMEC-1 sejtekben, de nagyobb volt az NIH/3T3 sejtekben.
A sztrómasejtek szennyeződésének hatása a miRNS szintre a CLL sejt szuszpenziókban. A CLL-sejteket hat lyukú lemezeken tenyésztettük 3x106/ml koncentrációban 60% összefolyó stromális sejteken 24 órán át. A miR-99a-t és miR-125b-t RT-qPCR segítségével detektáltuk TaqMan mikroRNS-vizsgálatokkal. ( a ) MicroRNS szintek a CLL sejtekben BM-MSC vagy HMEC-1 tenyésztés után. A CLL sejteket óvatosan fel és le pipettázással kaptuk. Az eredményeket U6 RNS-re normalizáltuk. ( b ) A mikroRNS mennyiségi meghatározása önmagában tenyésztett és sztrómasejt-felülúszóval kevert CLL-sejtekben. A sejtek szétválasztásának megakadályozása érdekében a stromális sejtek felülúszóit és a CLL szuszpenziókat előzetes pipettázás nélkül eltávolítottuk a kútból. ( c ) MicroRNS-szintek a CLL-sejtekben és a stromális sejtek felülúszóiból nyert pelletekben. Az eredményeket az RNS azonos térfogatú RT-qPCR-jének megfelelő Ct-értékekben adjuk meg. ( d ) A mikro-RNS mennyiségi meghatározása CLL-sejtekben, szándékosan sztróma sejtekkel szennyezve, 1: 1000 stroma: CLL sejtek arányban. Az eredményeket U6 RNS-re normalizáltuk.
Teljes méretű kép
A miRNS stromális sejtekből a CLL sejtekbe történő extracelluláris vezikulákon keresztül 13 vagy sejtközi intercelluláris kommunikáció (GJIC) útján történő lehetséges transzferjének meghatározásához 14 CLL sejtet és stromális sejtet együtt tenyésztettünk egy membránnal (0,4 μm pórusok, Transwell, Corning, Amsterdam, A.) Vagy a GJIC inhibitor 1-oktanol (0,5 μM, Sigma, Diegem, Belgium) jelenlétében. Megállapítottuk, hogy a membrán eltörölte a miR-99a és miR-125b szint növekedését a CLL sejtekben, míg a GJIC inhibitor nem mutatott hatást (az adatokat nem közöltük). Ezek az eredmények kizárják ezen miRNS-ek átvitelét a sztróma sejtekből a CLL sejtekbe extracelluláris vezikulumok vagy GJIC-ek révén.
Összefoglalva, a bemutatott megfigyelések hangsúlyozzák, hogy meghatározott kísérleti körülmények között nagyon korlátozott számú szennyező sejt vezethet artefakt eredményekhez a miRNS mennyiségi meghatározása szempontjából. Ez a jelentés hangsúlyozza az átfogó együttműködési rendszerek megfelelő ellenőrzésének szükségességét. E vizsgálat fényében a vegyes sejtpopulációk 99,9% -os tisztaságú válogatása nem mindig akadályozza meg a miRNS-expresszióval kapcsolatos téves következtetéseket. A jelenlegi módszerek nagy érzékenysége miatt hasonló aggályok vonatkozhatnak az mRNS és a fehérje elemzésekre is.
További információ
PDF fájlok
Kiegészítő táblázat
A szerző közleményei
A JP és az EM megtervezte és elvégezte a kutatást, elemezte az adatokat és megírta a kéziratot; GB toborzott CLL-betegeket és szerkesztette a kéziratot.