- elemeket
- absztrakt
- bevezetés
- A kromoszóma kiterjedésű génrepresszió és Xi epigenetikus módosítása
- A nem kódoló gének elnémításának mechanizmusa Xist RNS
- Az inaktiválási folyamat szabályozása X
- X-inaktiváció megőrzése és divergenciája emlősökben
- Következtetések az inaktiválási mechanizmusról X
elemeket
- Dózis kompenzáció
- Epigenetika
- Génszabályozás
absztrakt
Az emlősök inaktiválják a két női X kromoszóma egyikét, hogy ellensúlyozzák az egyenlőtlen, X-hez kapcsolódó gén kópiaszámokat a hímek és a nők között. Az X inaktiválásnak ez a folyamata egy X kromoszóma elnémítását eredményezi fejlődésileg szabályozott módon. Ebben a munkában megvizsgáljuk az X inaktivációval kapcsolatos legújabb megállapításokat, és megvitatjuk, hogy ezek az előrelépések hogyan javítják a mechanikai megértést. Ez utóbbi eredmények betekintést nyújtanak abba, hogy egy sejt hogyan számolja és választja ki az inaktiválandó X-kromoszómák megfelelő számát, például az egész kromoszómában az összehangolt génrepressziót, és hogyan képződik egy stabil inaktív X-kromoszóma. Ennek a komplex szabályozási rendszernek a legfontosabb összetevőit már meghatározták, és ezek belépési pontokat kínálnak az emlősök epigenetikus szabályozásának megértéséhez. Az adatok nagy részét egérvizsgálatból nyertük. Jelenleg nem világos, hogy ezek az eredmények milyen általános módon alkalmazhatók más emlősfajokra. Ezt a szempontot megpróbáljuk felmérni a rendelkezésre álló adatok alapján.
Egerekben a Xist RNS az X kromoszóma régió magjának nongén kromatinja felett képződik (Chaumeil et al., 2006). Még a humán Xi XIST-en is látszik, hogy a kromoszóma-régió központi régiója, amely többnyire genomiális ismétlődéseket tartalmaz, átfedi egymást (Clemson et al., 2006). Ez arra utal, hogy a Xist elsődleges célpontjai nem gének, hanem szekvenciák az X kromoszóma nem genetikai régióiban . Xi-nél a gének a Xist domén szélén helyezkednek el, függetlenül attól, hogy elnémultak-e vagy sem (Clemson és mtsai. 2006). Xi helyzete nehéz. Sok gén az emberi Xi-n és számos gén az egér Xi-n menekül a géncsendesítés elől, és expresszálódik Xi-ből és az aktív X-kromoszómából (Xa). Az nem teljesen világos, hogy mi határozza meg, hogy egy gén elnémul, vagy aktív marad-e Xi-n. A legfrissebb eredmények azt mutatják, hogy az egerek menekülési génjeinek legalább egyike, a Jarid1c olyan elemeket tartalmaz, amelyek az aktív állapotát meghatározzák, függetlenül az Xi-n lévő kromoszóma-helyzetétől (Li és Carrel, 2008). Ez arra utal, hogy a gén lokuszának kromoszóma szekvenciái vagy tulajdonságai modulálják azt a hatást, amelyet a Xist kifejt az expresszióra. Az sem ismert, hogy a Xist hogyan nyomja el az elsődleges, nem genetikai kötőhelyek génjeit, bár bizonyítékot nyertek a nukleáris rekeszizálódásra (Heard és Bickmore, 2007; Chow és Heard, 2009).
A kromoszóma kiterjedésű génrepresszió és Xi epigenetikus módosítása
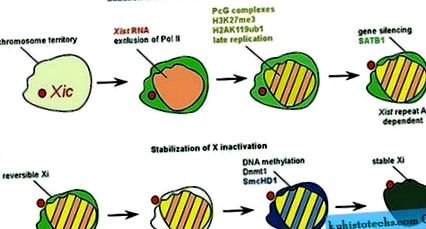
A női szomatikus sejtekben az Xi stabil heterokromatikus szerkezetet alkot, és különféle festési technikákkal vizualizálható. A heterokromatikus Xi génreaktivációja nehezen érhető el, hacsak a sejtek sorsának változásai nem váltanak ki a korai embrionális típusra történő átprogramozás során (Takagi et al., 1983). Az inaktív X reaktivációját figyelték meg indukált pluripotens őssejtek női egér szomatikus sejtekből történő előállítása során (Maherali et al., 2007). A szomatikus sejtekben meghatározott epigenetikus utak blokkolására irányuló kísérletek, beleértve a hiszton dezacetilezését és a DNS metilezését, kis számú sejtben elérték az Xi részleges reaktivációját (Csankovszki et al., 2001). Ez arra a következtetésre vezetett, hogy a gének elnémítását Xi-en számos olyan epigenetikus tényező közvetíti, amelyek együtt működnek a kromoszóma inaktív állapotának fenntartásában. Xi számos módosításon megy keresztül, és olyan tényezőkkel gazdagodik, amelyek a néma kromatinnal társultak (1. ábra). Ilyen tényező a hiszton-variáns, a macroH2A, amely szinte egyenletesen oszlik el Xi-szerte a szomatikus sejtekben (Mietton és mtsai, 2009). Ez arra utalhat, hogy a stabil inaktiváció elérése után a géneket és a nem genetikai szekvenciákat az Xi-hez hasonló epigenetikai módosítások fedik le.
Teljes méretű kép
Az Xi kromatin-összetétele jelentősen eltér a szomatikus sejtekben található többi kromoszómától. Xi számos hiszton-modifikációval gazdagodik, mint például a lizin 27 hiszton H3 metilezése és a H2A hiszton ubiquitation (Plath et al., 2003; de Napoles et al., 2004; Fang et al., 2004). Ez párhuzamosan zajlik a Polycomb komplexek toborzásával (1a. Ábra), amelyekről kimutatták, hogy katalizálják ezeket a hiszton módosításokat (Plath és mtsai, 2004). Ezenkívül a H4 hiszton hipoacetilezett, és a H3 hiszton 4-es lizinnel végzett di- és tri-metilezése erőteljesen Xi-re redukálódik (Chaumeil és mtsai., 2002). Ezek a hiszton-módosítások általában korrelálnak a génexpresszióval, és ezeknek a kromatin-módosításoknak a Xi-re való redukciója transzkripciós inaktivitásának következményeként értelmezhető. Jellemezni kell a Polycomb fehérjék és a hiszton módosítások funkcióit, valamint egyéb Xi komponenseket, amelyek magukban foglalják a hiszton variáns makroH2A-t, valamint a SAF-A nukleáris állványfehérjét (Fackelmayer, 2005). A jelenlegi nézet szerint több kromatin marker járul hozzá az Xi elnyomásának fenntartásához (Csankovszki et al., 2001; Hernandez-Munoz et al., 2005).
A nem Xist RNS gének elnémításának mechanizmusa
Az X inaktiváció általában egerekben a korai embriogenezis során kezdődik. Az egér embrionális őssejtjeinek differenciálódásában szintén megfigyelhető a hatóanyag átalakítása transzkripciósan csendes X kromoszómává. Ez egy hatékony sejttenyésztési rendszert biztosít a kromoszómában történő elnémítás mechanizmusának tanulmányozásához (Payer és Lee, 2008). Az inaktiválást a Xist RNS felhalmozódása indukálja a jövőben Xi-ben. Az 5'-Xist-nél konzervált szekvenciára, az úgynevezett A ismétlésre van szükség a gének elnémításához (Wutz et al., 2002). A Xist expressziója A ismétlés nélkül nem okoz génrepressziót, de a Xist lokalizációjához és a legtöbb kromatin-módosítás Xi-hez történő toborzásához vezet (Chaumeil et al., 2006). Úgy gondolják, hogy az ismétlődő RNS-motívum olyan hurk-struktúrává áll össze, amely kötődési helyként funkcionálhat az elnémító tényezők számára (Wutz és mtsai., 2002). A közelmúltban kísérletileg vizsgálták az A RNS ismétlés szerkezetét is (Duszczyk et al., 2008). Ez a tanulmány megerősítette az első szárhurkot azzal a további megállapítással, hogy az RNS motívuma dimerizálódhat egy olyan szekvencián keresztül, amelyet korábban a második hurok kialakítására terveztek. Az A ismétlés törlése egerekben a Tsix antisense gén Xi-ben való visszaszorításának funkcióját is feltárta, ami további funkciókat javasol az A ismétlődő régió számára az X inaktiváció szabályozásában (Hoki et al., 2009).
A gén Xistu repressziója a kromoszómában bizonyos sejttípusokra korlátozódik. Normális esetben az X inaktiváció a korai embrionális sejtekben kezdődik. Ezenkívül kimutatták, hogy a vérrendszerben lévő specifikus progenitorok megfelelő sejtkontextussal rendelkeznek a csendesítés megindításához (Savarese et al., 2006). Ezt olyan kísérletekkel igazolták, amelyek indukálható expressziós rendszert használtak a Xist aktiválására hím egerekben. A XIST expresszió gén repressziót is okozhat egyes emberi szomatikus sejtvonalakban, változó fokú kromatin módosítással (Chow és mtsai, 2007). Nemrégiben bebizonyosodott, hogy a Xist képes elindítani a kromoszóma elnémítását az egér limfómából származó tumorsejtekben (Agrelo és mtsai, 2009). Ez a megállapítás felveti a kérdést, hogy vajon az epigenetikus utak, amelyek normálisan aktívak az X inaktiválása során az embrióban, elérhetőek-e a tumorsejtek számára, és ezek az utak hozzájárulnak-e a tumorgenezishez.
Az inaktiválási folyamat szabályozása X
Inaktivációs szabályozás X. a ) Az inaktiválást fejlődésileg kontrollált módon kezdik meg. Az X kivételével az összes kromoszóma inaktiválódik a diploid sejtben. Jelenleg az a vélemény, hogy ezt Xist kifejezésének szabályozásával érik el. A Xist szabályozás elemei alkotják a Xic régiót. Az X inaktiválás kezdetén az Xic régiók transzkromoszómális párosítása vélhetően egyetlen X kromoszóma Xist expresszióját váltja ki. Ez a gének elnémításához vezet az egész kromoszómában és Xi képződéséhez. ( b ) Azok az elemek, amelyek az Xic-ben az Xist expressziót szabályozzák, tartalmazzák a nem kódoló Tsix átírást (zöld). A Tsix antiszensz orientációban van átírva, átfedi a Xist transzkripciós egységet és elnyomja a Xist expressziót. Az Xic-en belül számos Oct4 kötőhelyet (piros kör) azonosítottak és közvetítik a Xist repressziót Tsix-függő és Tsix-független módokban. A CTCF részt vesz a Tsix expresszióban és az Xic párosításban is .
Teljes méretű kép
Egerekben a Xist expressziót visszaszorítja az antiszensz Tsix RNS (2b. Ábra). A Tsix transzkripciós egység átfedi az Xist, és egy antiszensz párot hoz létre. Ez a Xist-Tsix antiszensz párosítás felvetette a kettős szálú RNS lehetséges részvételének gondolatát, amelyet Dicer kis RNS-ekké dolgozhat fel. Valóban, ezeket a kis RNS-eket egy nemrégiben készült tanulmányban találták meg (Ogawa et al., 2008). Az embrionális őssejtek átfogó elemzése azonban kimutatta, hogy a Dicer deléciója csekély hatással van az X inaktivációs folyamatra, ami arra utal, hogy Dicer nem játszik jelentős szerepet az X inaktiváció szabályozásában (Kanellopoulou és mtsai, 2009). A Dicera törlése látszólag deregulálja az endogén mikroRNS-ek feldolgozását, ami a DNS metilációjának elvesztéséhez vezet, és ezáltal befolyásolja az X inaktiválódását is (Nesterova et al., 2008). Ezek az adatok összhangban állnak a Dicer X inaktivációra gyakorolt közvetett hatásával, és a kettős szálú RNS kérdése az X inaktivációban további vizsgálatokat nyit meg.
Az Oct4 őssejt transzkripciós faktor nemrégiben bekapcsolódott az egerek Xist expressziójának szabályozásába (Navarro et al., 2008; Donohoe et al., 2009). Kimutatták, hogy az Oct4 megköti a DNS-szekvenciákat az Xist intron 1-ben, valamint a Tsix promoter és enhancer szekvenciák körül (2b. Ábra). Beszámoltak arról, hogy az október 4 a Xist elnyomását közvetíti a Tsix-függő és a Tsix-független kezelési módokban. Így az Oct4 expresszió korlátozhatja a Xista újraszabályozását az X inaktiváció kezdetéig. Az Oct4 azonban a Xistával együtt magas szinten expresszálódik az egér embrionális őssejtjeitől eltérő sejtvonalakon is, beleértve az egér epiblasztjaiból származó őssejteket (Navarro és Avner, 2009). Ezért az Oct4 kifejezés valószínűleg nem az egyetlen meghatározója a Xista-szabályozásnak, és egy másik kontrollréteg várhat a.
X-inaktiváció megőrzése és divergenciája emlősökben
Következtetések az inaktiválási mechanizmusról X
A véletlen X inaktiválás kizárólag placenta emlősökben alakult ki. Ez arra utal, hogy a dóziskompenzációs rendszer olyan folyamatokra támaszkodik, amelyek a gerinceseknél nagyobb mértékben közvetítik a génszabályozást. Figyelemre méltó kivétel a nem kódoló Xist RNS és Xic szabályozó szekvenciák. Ezeket kifejezetten az adag kompenzálására fejlesztették ki. Bizonyíték van arra is, hogy a szabályozó elemek fejlődése nem állt le, és még a jelenlegi emlősöknél is megvalósulhat. Az X inaktiváció szabályozása magában foglalja a kromoszóma párosítást és az antiszensz elnyomást. A Tsix, CTCF, Oct4 és Polycomb komplexek molekuláris szereplőként vesznek részt ebben a folyamatban. A kromoszómában a csendet nem kódoló Xist RNS indukálja, és úgy tűnik, hogy ez egy többlépcsős folyamat. A Xist és a SATB1 elindítja a géncsendesítést, az SmcHD1 és a DNS-metiláció döntő szerepet játszik az Xi-elnyomás fenntartásában. A polikombás komplexek részt vesznek a teljes X kromoszóma elnémításában, de pontos működésüket meg kell vizsgálni.
Xist célja a kromoszómán ismeretlen. Számos tanulmány sugallta a genomiális ismétlődések és a nem genetikai DNS szerepét az X inaktiválásában, a géneket és a nem genetikai kromatint Xi-n térben elkülönítették. Az a megfigyelés, hogy a Xist átfedi az X kromoszóma régió ismétlődő gazdag központját, arra utal, hogy a nem genetikai kromatin lehet a Xist elsődleges célpontja. Ez azt a gondolatot nyitja meg, hogy az X inaktiválása együttesen választhatja ki az elemek ismételt tompításának már meglévő mechanizmusát. A genomi ismétlések tartalmazzák a mobil genetikai elemek maradványait, amelyek behatoltak a genomba és ezt követően inaktiválták. Ez magában foglalja a befogadó védelmi mechanizmusainak fejlesztését. Lehet-e egy inaktív X a gazdavédelmi stratégiák kontrollált részvételének eredménye, amelyet a Xista expresszió indukál? Felvetődött, hogy a hosszú szétszórtan ismétlődő elemek (LINE) funkciót töltenek be az X inaktiváció terjedésében, a közelmúltban összehasonlították az X inaktiválást olyan emlősöknél, amelyekben a LINE proliferáció leállt. Ezek az adatok azt jelzik, hogy az X inaktiválásához nem feltétlenül szükséges a LINE amplifikáció, ami arra utal, hogy más elemtípusok is hasonló szerepet játszhatnak az X inaktiválásában (Cantrell et al., 2009).
Az X inaktiválás megértésének előrehaladása új és egyértelműbb kérdéseket vetett fel. Meg kell határozni azokat a tényezőket, amelyek közvetítik a transz-kromoszóma kölcsönhatásokat az Xic-Xic párosítás során az X inaktiváció kezdetén. A géncsendesítési út megértésének kulcsfontosságú hiányzó eleme a kapcsolat az SATB1 és a Xist A ismétlés között. Ezekre a kérdésekre adott válaszok nemcsak elősegítik az emlősök dózis-kompenzációjának megértését, hanem betekintést nyújtanak az emlősök epigenetikus szabályozásának alapvető nukleáris folyamataiba is.
- Laura Markham 8 olyan szabályok, amelyek segítenek a 10-12 éves gyermekek oktatásában
- Melyik gumicsizmát válassza a babának New Time
- Michalovce - Portál elektronické služeb Elektronické služby Egyszeri juttatás biztosítása
- Vércsoportok, öröklődés és immunitás - Föld; Kor
- A húst, amit valóban megeszünk