absztrakt
A fő
A BMT utáni javuló túlélés miatt aplastikus vérszegénységben vagy limfematológiai rosszindulatú daganatokban egyre nagyobb probléma merül fel a termékenység későbbi állapotával kapcsolatos tanácsadással kapcsolatban. Ezenkívül az új kondicionáló rendszerek bevezetése különböző hatásokkal járhat a férfiak szaporodására. Bár a sperma mélyhűtését mindig meg kell tervezni a citotoxikus kezelés megkezdése előtt, gyakran ez az eljárás különböző okok miatt nem lehetséges. Először is, amikor a betegeket, és gyakran orvosaikat fiatal korban diagnosztizálják rákban, előfordulhat, hogy a kezelés megkezdése előtt nem lesznek felkészülve a jövőbeni termékenységi problémák tervezésére. Másodszor, a fagyasztás nem biztos, hogy minden rákközpontban elérhető. Harmadszor, néhány betegnél a rákbetegség miatti gyenge spermiumminőséget korábban alkalmatlannak tartották fagyasztásra az intracitoplazmatikus spermiuminjekció (ICSI) bevezetéséig, ez egy új technika, amely lehetővé teszi az in vitro megtermékenyítést kis mennyiségű spermiummal. A tanulmány célja a spermatogenezis helyreállításának mértékének, minőségének és kinetikájának értékelése volt 64, különféle myeloablatív kezelést kapó betegnél.
Betegek és módszerek
2000 decemberében áttekintették azoknak a 64 férfinak a klinikai táblázatait, akik 1982 és 1996 között allogén BMT-n estek át az olaszországi genovai San Martino Kórház Hematológiai Tanszékén, és amelynek legalább egy kezelés utáni spermium-elemzése volt.
Minden rosszindulatú daganat típusát, korábbi kemoterápiáját, kondicionálási rendjét, a BMT életkorát és a korábbi reproduktív kórtörténetet, valamint a termékenységet monitorozták. A legtöbb spermaelemzést a Genovai Egyetem Szülészeti és Nőgyógyászati Tanszékének andrológiai laboratóriumában végezték. A spermiummintákat maszturbációval vettük 3 nap szexuális absztinencia után. A spermium elemzés a spermium térfogatának, a spermiumok mozgékonyságának és a spermiumok számának standard módszerekkel történő értékeléséből állt, a következő WHO protokollok szerint. 1 A betegeket akkor tekintettük azoospermiumnak, amikor a kétkamrás hemacitométer (Neubauer Improved) egyetlen területén sem centrifugálás előtt és után sem találtak spermát a mintában. Amikor a spermiumokat csak centrifugálás után észlelték, a betegeket kriptospermiumnak tekintették. A súlyos oligozoospermiát akkor határozták meg, amikor a spermiumszám 20 × 106/ml volt. A spermiumok mozgékonyságát egy egyszerű osztályozási rendszerrel értékelték a WHO protokoll szerint. 1 A spermiumok morfológiáját festett tárgylemezeken (Papanicolaou festés) értékeltük 100x olajlámpa fénymezőbe és 10x szemdarab (Leitz) lencsével, amikor legalább 200 spermium állt rendelkezésre vizsgálatra.
Az összes összegyűjtött adatot egy számítógépes rendszer értékelte, és az SAS elemezte (V8 kiadás, SAS Institute, Cary, NC, USA). A kategóriákhoz Chi-square vagy Fisher pontos teszteket használtak, a kvantitatív változókhoz pedig az általános lineáris modellt (GLM). A változók kölcsönös eloszlásának értékelésére korrelációs elemzést is alkalmaztak.
az eredmény
A transzplantált betegek átlagéletkora 27,39 ± 8, 16 (9-50) volt. Tizennyolc betegnek (28%) volt egy vagy több gyermeke a BMT beadása előtt. Közülük csak 8-an végeztek spermium-analízist a BMT előtt, közülük 75% -uk mutatott normozoospermiás paramétereket.
A BMT indikációi a következők voltak: súlyos aplastikus vérszegénység (SAA, n = 11), akut limfocita leukémia (ALL, n = 7), akut mielogén leukémia (AML, n = 25), krónikus myelocytás leukémia (CML, n = 17) ), a nem Hodgkin-limfóma (NHL, n = 3) és a Hodgkin-kór egy esete (HD).
A graft előkészítési rendjét és a BMT után végzett utolsó spermaminta eredményeit az 1. táblázat mutatja. A követés 1-18 évig terjed (medián 4 év).
Asztal teljes méretben
A BMT előtt minden rosszindulatú daganatos beteg különböző adagokban és adagolási rendben kapott kemoterápiát. 45 esetben sikerült megbecsülni a kemoterápia és a BMT vége óta eltelt időt, amely 1 nap és 31 hónap között volt (átlagosan 158,7 nap), és az esetek 60% -ában 100 vagy több nap volt (45-ből 27 betegek).,
Azoospermia előfordulása a BMT után
A BMT után az azoospermia legnagyobb előfordulási gyakoriságát CY-vel, TBI-vel vagy TAI-val készített betegeknél találták (85,4%). A CY-vel plusz BU-val vagy tiotepával kezelt betegek közül 50% maradt azoospermikus. Ezzel szemben a kizárólag CY-ben részesülő betegek 10% -ának volt azoospermia. Az egyetlen CY-ben előkészített betegnél, aki nem mutatta ki a spermatogenezist, az utolsó spermaminta csak 2 évvel a BMT után volt.
Nem volt statisztikai összefüggés a BMT életkora és a spermatogenezis folytatása között.
A spermatogenezis regenerációjának minősége
Azoknál a betegeknél, akik bizonyos fokú spermatogenezist értek el (2. táblázat), a WHO kritériumai szerint normozoospermiát észleltek nyolc betegnél CY kondicionálás után, és egy betegnél (CVi) CY és TBI kondicionálás után.
Asztal teljes méretben
A spermatogenezis regenerációjának kinetikája
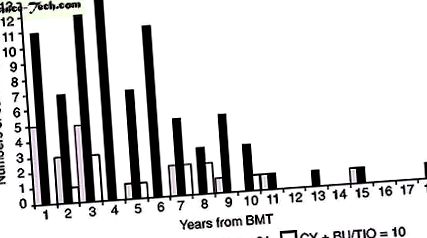
Huszonkét betegnél több spermium-elemzés történt a BMT után különböző időpontokban. A spermatogenezis regenerációjának kinetikája statisztikailag nem elemezhető a megfigyelések különböző időintervallumokban történő szabálytalan eloszlása miatt (1. és 2. ábra). CY + TBI után a spermatogenezis regenerációja a transzplantáció után 4 évvel nem volt megfigyelhető, és két esetben 6 és 8 év elteltével igazoltuk azoospermás minták alapján. A CY kondicionálási rendet követően a transzplantáció után 1 évvel vizsgált betegek 60% -ánál spermatogenezis helyreállítását figyelték meg.
Megfigyelések (spermaminták) száma a BMT-től eltérő időintervallumokban, a kondicionálási rend szerint.
Teljes méretű kép
A spermatogenezis helyreállítása BMT után (a betegek százaléka) a kondicionáló rend szerint.
Teljes méretű kép
Apaság a BMT után
Hat beteg spontán a BMT után (2. táblázat). A hét született csecsemő között nem számoltak be genetikai hibákról vagy rendellenességekről.
vita
Bár a BMT után terhességről számoltak be, az apaságot a legtöbb esetben nem ellenőrizték, és a fogamzást, különösen a TBI kondicionáló kezeléseknél, szórványos eseménynek lehet tekinteni. 2, 3, 4, 5, 6 Ezenkívül, bár a limfohaematológiai rosszindulatú daganatok kezelése után spontán fogant élő születéseknél jelentett veleszületett rendellenességek előfordulása összehasonlítható az általános populációban tapasztaltakkal, a spermiumok 2 lehetséges hosszú távú genetikai károsodása nem kizárt. Számos állatkísérlet vizsgálta a sugárzás és a kemoterápia lehetséges káros hatásait a kezelt hímek utódaira. Emberekben a kemoterápia után 100 napon belül dokumentálták a sperma aneuploidia átmeneti növekedését .
Ezen érvek alapján spermabankot kell biztosítani minden olyan férfibetegnek, aki a kezelés előtt bármilyen BMT-n átesett, még akkor is, ha a spermatogenezis már károsodott a limfohematológiai malignus daganat miatt. Valójában az intracitoplazmatikus spermium injekció (ICSI) megnövelte annak esélyét, hogy rossz spermiumszámmal rendelkező férfiakat kezeljenek, és minden olyan mintán, ahol akár alkalmi spermiumok is kimutathatók, ma már alkalmasnak tekintik a banki tevékenységet. 12, 13
Egy másik kérdés, amellyel foglalkozni kell ebben a vitában, hogy meg lehet-e tervezni a spermabankot azoknak a betegeknek, akik már megkezdték a kemoterápiát, ha nem korábban. Ennek a problémának a kezelésére elemeztük a BMT előtt 30 spermiummintát, akik ugyanazokkal a jellemzőkkel és betegségekkel jártak, mint a különböző kemoterápiás kezeléseken átesett vizsgálati populáció. E betegek túlnyomó többségének minimumkövetelményei lennének a spermiumok krioprezerválásához, csak 5 (16,6%) betegnek volt azoospermiája.
Bár a legtöbb betegben lehetséges, a spermiumok banki kezelése (1) ebben a szakaszban elutasítható (1) az utódok genetikai károsodását mutató állatok adatai alapján; (2) csak akkor engedélyezett, ha 100 vagy több nap telt el (ebben a vizsgálatban az esetek 60% -a) a kemoterápia vége óta, az emberi spermiumokban jelentett magas aneuploidia előfordulása alapján; (3) bármikor megengedheti, miután a beteget a mélyhűtés előtt tájékoztatta, hogy esetleg nem tudja használni a mintát, ha új adatok állnak rendelkezésre a kemoterápia spermára gyakorolt negatív hosszú távú genetikai hatásairól.
Körülbelül 20 évvel ezelőtt mutatták ki a leggyakrabban alkalmazott kondicionáló kezelés (CY + TBI) negatív hatását az allogén BMT-re a spermiumszámra. 14 Sanders és mtsai. 14 ember értékelte a nemi mirigy működését 1-11 évvel a BMT után, és a spermatogenezisről számolt be 15 férfinak 10-ben, akik CY-vel készültek, és 32-ből csak kettő készült CY-vel és TBI-vel. A Sanders-tanulmány óta a BMT utáni spermatogenezis vizsgálatról nem tettek közzé jelentősebb adatokat. Jacob és mtsai 15 42 betegről számoltak be, akiken allogén vagy autológ BMT vagy perifériás őssejt-transzplantációt hajtottak végre, bár csak 25 betegből nyertek spermamintát. Egy friss publikáció, amely a buszulfán és a ciklofoszfamid kondicionáló kezelés BMT-re gyakorolt hatását értékeli, 26 vizsgált férfi közül 21-ben számolt be kimutatható spermiumról, átlagosan 5 évvel a transzplantáció után. 16.
Ez a tanulmány, amely 64 betegnél a BMT után kapott 99 spermaminta eredményét közli, további információkat nyújt a beteg tanácsadásához és a későbbi spermium-elemzések pontosabb ütemezésének megtervezéséhez szükséges szükségességét ezeknél a betegeknél.
A TBI utáni azoospermia előfordulása túlértékelhető a követés hossza miatt. Ebben a tanulmányban a spermatogenezis helyreállítása csak 9 évvel az átültetés után következett be egy évvel korábban azoospermikus páciensnél. Másrészt 22 beteget (45,8%) osztályoztak azoospermiumnak a transzplantációt követő 4. évben vagy azt megelőzően kapott spermaminta alapján. A CY-BU vagy CY-thio esetek száma nem elég nagy a következtetések levonásához. Az ezen kezelési módok után megfigyelt magasabb spermatogenezis-helyreállítási tendencia a CY-TBI-hez képest (P = 0,069), ha nagyobb vizsgálatok igazolják, kedvezne a BU vagy a tiotepa választásának a fiatal férfiak kondicionálásában. A CY kondicionáló kezeléssel a spermatogenezis több esetben fennmarad (90%).
A mai napig kimutatták, hogy a nők ivarmirigy-regenerációja a BMT idején az életkortól és a menarchikus állapottól függ. Ebben a vizsgálatban a transzplantációkor a férfi életkora nem korrelált a spermatogenezis regenerációjával.
A BMT utáni spermatogenezis helyreállításának kinetikájáról nem vonhatunk le végleges következtetéseket a vizsgálat retrospektív jellege miatt, amely nem tette lehetővé a statisztikai elemzéshez szükséges összes minta rögzítését. Tapasztalataink alapján azonban azt javasoljuk, hogy a CY kondicionálás alatt álló betegeket a transzplantáció után 1 évvel vizsgálják meg, míg a TBI után a betegeket a BMT után 4 évvel nem szabad megvizsgálni. Ezenkívül a TBI után fontos, hogy hosszabb ideig (akár 9-10 évig) folytassuk az utánkövetést, mielőtt következtetéseket vonnánk le a beteg termékenységi állapotáról.
- Allogén vagy autológ csontvelő-transzplantáció (bmt) non-Hodgkin-limfóma (nhl) eredményei esetén
- A HÉT ELEMZÉSE A családtámogatásnak nem csupán az ellátások növelését kell jelentenie
- Vér- és ürülékelemzés a Giardián gyermekeknél és felnőtteknél, hogyan kell ezt megtenni Az iLive egészségéről
- ELEMZÉS J
- Hogyan segítsünk egy kórházban - Ľubovnianska nemocnica, n