absztrakt
Ez az áttekintés azt a legújabb bizonyítékot posztulálja és mutatja be, hogy az inzulinrezisztencia elindul a zsírszövetben, és arra is utal, hogy a zsírszövet kulcsszerepet játszhat az izom és a máj inzulinrezisztenciájának kiváltásában. Az intracelluláris inzulin szignál kaszkád jelentős rendellenességei vannak a 2-es típusú cukorbetegségben szenvedő betegek zsírsejtjeiben, ideértve az IRS-1 gén és fehérje csökkent expresszióját, az inzulin által stimulált PI3-kináz aktivitást és a PKB/Akt aktivitást. Ezzel szemben a cukorbetegeknél a vázizomban lévő upstream inzulinjelzés csak enyhe károsodást mutat, és az inzulin in vivo PKB/Akt-aktivációja normálisnak tűnik. Az inzulin által stimulált glükóz transzport és a glikogén szintézis azonban jelentősen csökken.
Hasonló szignifikáns károsodások az inzulinszignalizációban, beleértve az IRS-1 expresszió csökkenését, az inzulinnal stimulált PI3-kináz aktivitás romlását és a PKB/Akt aktivitást néhány ((30%) normoglikémiás egyénnél, akik genetikai hajlamot mutatnak a 2-es típusú cukorbetegségre. jelentősen csökken ezekben a sejtekben, ami hasonló a diabéteszes sejtekben megfigyeltekhez. Azok a személyek, akiknek csökkent az IRS-1 és a GLUT4 sejt expressziója, szintén jelentősen ellenállnak az inzulinnak, és az inzulinrezisztencia szindróma számos jellemzőjét mutatják.
Tehát a normoglikémiás alanyok zsírsejtjeiben "diabéteszes" mintázat figyelhető meg, amely in vivo jelentős inzulinrezisztenciával jár. Úgy gondolják, hogy az inzulinrezisztencia és/vagy annak effektorai az adipocitákban indulnak el, és ez másodlagos lehet más inzulin célszöveteknél, ideértve az izmok glükóz transzportjának károsodását is.
A teljes test inzulinérzékenységének és az euglikémiás módszer hatásának becslése elsősorban a glükóz izomok szerinti lebontását tükrözi (60–70%). A zsírszövet az egész testnek csak 10% -át képviseli, a máj glükózfelvételének pedig ∼ 30% -át. Az inzulin-stimulált glükóz clearance csökkenése az euglikémiás bilincs alatt elsősorban az izom glükózfelvételének csökkenésének tudható be. Ez ahhoz az extrapolációhoz vezetett, hogy az egész test inzulinrezisztenciája nemcsak az izmokban, hanem az izmokban is jelentkezik. Ez egy indokolatlan extrapoláció, amely oda vezethet, hogy helytelenül keressük a kórokozó mechanizmusokat.
Az állatmodellek, mind a transzgenikus túlexpresszió, mind a génkiütések izgalmas betekintést nyújtottak a specifikus gén túlexpresszió vagy abláció fenotípusos következményeibe. Az IRS-1 és az IRS-2 fontos dokkoló fehérjéinek géneltávolítása növekedéskorlátozott és jelentősen inzulinrezisztens (IRS-1) 2 vagy inzulinrezisztens és cukorbeteg állatokat eredményezett károsodott inzulinszekrécióval (IRS-2). 3 Az izomspecifikus GLUT4 abláció inzulinrezisztenciához vezet, 4 de a genotikus glut4 specifikus kiütéshez hasonlóan, valójában a hasonlónak látszóhoz. Ez a megállapítás nyilvánvalóan nincs összhangban a zsírszövet fontos szerepével a glükóz eliminálásában az egész testben. Egy másik érdekes megállapítás az állatmodellekben az, hogy a GLUT4 izom kimerülése a zsír glükóz felvételének és a zsírszövetek kibővült tömegének jelentős növekedésével jár. Ez a szövetek közötti összekapcsolás alátámasztja annak lehetőségét, hogy az egyik szövetben inzulinrezisztencia indulhasson meg, majd események sora következzen be más szövetekben/szervekben.
Ez a rövid áttekintés összefoglalja a legutóbbi emberekkel kapcsolatos megállapításokat, amelyek azt mutatják, hogy az inzulinrezisztencia és az inzulinhatás károsodása kezdetben a zsírszövetben fordul elő; valójában jóval a glükóz intolerancia kialakulása előtt. Ezután feltételezik, hogy a zsírszövet kezdeményezheti és/vagy lehet az inzulin kezdeti célszerve, ahol inzulinrezisztencia alakul ki. A legfrissebb adatokat megvizsgálják, ahol az inzulin jelátvitelét és hatását tanulmányozták emberi célszövetekben inzulinrezisztens körülmények között, különösen 2-es típusú cukorbetegségben. Mivel az emberi májban az inzulinreceptor mögött gyakorlatilag semmit sem lehet tudni, az összehasonlítás csak a vázizomzat és a zsírsejtek között lehetséges.
2-es típusú diabétesz
Nemrégiben megvizsgálták az inzulin infúzióját vagy in vivo infúziót, vagy in vitro hozzáadását a 2-es típusú cukorbetegségben szenvedő betegek vázizomzatának glükóz transzportjára és inzulinjelzésére. A legjelentősebb megállapítás a tirozin-stimulált inzulin-stimulált IRS-1 foszforilezésének károsodása, amely a PI3-kináz aktivitás 50% -os csökkenésével jár. A fontos szerin/treonin kináz PKB/Akt downstream aktiválása azonban normálisnak tűnik, vagy csak in vitro hozzáadott inzulin szuprapsziológiai koncentrációjának jelenlétében. Úgy tűnik, hogy a tirozin-foszforiláció zavara nem az IRS-1 fehérje csökkent expressziójának köszönhető, bár egyes sejtekben alacsonyabb szintet figyeltek meg a terhességi cukorbetegségben. Az IRS-1 fokozott szerin-foszforilációja csökkentheti az inzulinnal stimulált tirozin-foszforilációt, de jelenleg nem ismert, hogy ez a helyzet a 2-es típusú cukorbetegség esetén Összességében az adatok azt sugallják, hogy a PI3-kináz aktiválása és esetleg a PI3, 4- és foszfát-generáció PI3, 4, 5, csökken, de még mindig elegendő a downstream jelző események normális aktiválásához. Ez arra a következtetésre vezetett, hogy a vázizmok inzulinrezisztenciája az effektor vagy a szignálmolekulák PKB/Akt általi aktiválódásának zavara. 8.
Az inzulinnal stimulált glükóz transzport a csontvázizomzatban is csökken a 2-es típusú cukorbetegségben szenvedő betegeknél. 12 Meglepő módon azonban a legújabb in vitro vizsgálatok kimutatták, hogy ez elsősorban a "glükóz-toxicitásnak" köszönhető. A szöveti biopsziák csak 2 órán át történő előinkubálása magas glükózszint mellett rontja az inzulin hatását, 13 míg a diabéteszes izomzat 2 órás fiziológiai glükózszint mellett történő előinkubálása normalizálja az inzulinválaszt. Az is lehetséges, hogy az előinkubációs idő meghaladja más keringő antagonisták hatását az inzulin, például TNFa, interleukinek és/vagy szabad zsírsavak (FFA) hatására. A jelenleg rendelkezésre álló adatok azt sugallják, hogy a 2-es típusú cukorbetegségben szenvedő betegeknél csak mérsékelt és látszólag nem funkcionálisan kritikus rendellenességek vannak a PKB/Akt előtti vázizomzat szignalizációjában. Ezenkívül az inzulinnal stimulált káros glükóztranszport in vitro gyorsan reverzibilisnek tűnik, mivel a szövetmintákat fiziológiás glükózt tartalmazó friss táptalajban inkubálják. Ezek a megállapítások összhangban állnak azzal a következetes bizonyítékkal is, hogy a GLUT4 fehérjetartalma és az mRNS expressziója normális a vázizomzatban 2-es típusú cukorbetegségben. 7, 16
A zsírszövetben teljesen más a helyzet. A 2-es típusú cukorbetegségben szenvedő betegek adipocitáinak az IRS-1 által stimulált tirozin-foszforilációja is jelentősen csökken. Ez azonban elsősorban annak köszönhető, hogy az IRS-1 fehérje expressziója 70% -kal csökken. Hasonlóképpen, a teljes PI3-kináz aktivitás 70% -kal csökken. Ezzel szemben az IRS-2 expresszió normális, és ez a molekula válik az inzulin-stimulált PI3-kináz aktiváció fő dokkoló fehérjéjévé is. 17 A PI3-kináz csökkent aktivációjával összhangban a downstream PKB/Akt aktiváció is jelentősen csökken, elsősorban az inzulin-stimulált szerin-foszforiláció jelentős csökkenése miatt. Az inzulinra reagálva a glükóztranszport a 2-es típusú cukorbetegségben szenvedő betegek zsírsejtjeiben is csökken, az inzulinjelzés károsodása, valamint a GLUT4 fehérje és az mRNS expressziójának jelentős csökkenése (∼ 70–80%) miatt. 17, 19, 20
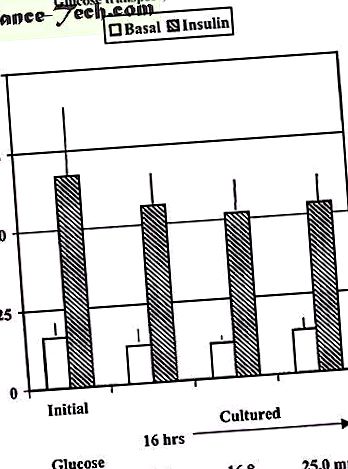
Az izomsejtektől eltérően, amint azt a fentiekben említettük, az emberi zsírsejtek 16 órás fiziológiás (5,6 mmol/l) vagy magas glükózkoncentrációjú (16, 8 és 25 mmol/l) előinkubálása nem zavarja az inzulin glükózra gyakorolt akut stimuláló hatását (1. ábra), és a diabéteszes sejtek fiziológiás glükózkoncentrációknál történő előinkubálása sem állítja vissza az akut inzulinválaszt 6 óra elteltével (publikálatlan megfigyelések). Ez összhangban van a csökkent GLUT4 fehérje expresszióval az adipocitákban, ami valószínűleg hosszabb megfordítási időt igényel.
A glükózfelvétel humán szubkután zsírszövet-explantánsok előtt (kezdeti) vagy 16 órás tenyésztés után 5, 6, 16, 7 vagy 25,0 mM glükózzal. A tenyésztési periódus után az izolált sejteket 60 percig 6,9 nM inzulinnal és 0,15 uCi [14CU] glükózzal inkubáltuk a glükózfelvétel meghatározásához. Az adatok négy külön kísérlet átlagai ± fél.
Teljes méretű kép
Az 1. táblázat összefoglalja az inzulin-stimulált izom- és zsíremelkedések fő különbségeit a 2-es típusú cukorbetegeknél a cukorbetegeknél.
Asztal teljes méretben
Normoglikémiás, inzulinrezisztens állapotok
Az IRS-1 fehérje expressziója elhízott egyének vagy 2-es típusú cukorbetegség nem elhízott egészséges rokonai zsírsejtjeiben. Carvalho és mtsai 28 engedélyével reprodukált adatok.
Teljes méretű kép
Így alacsony IRS-1 és GLUT4 gén- és fehérje-expresszió figyelhető meg a 2-es típusú cukorbetegségben szenvedő betegek zsírsejtjeiben, valamint az egészséges egyének csoportjában, különösen azokban, akiknél a 2-es típusú cukorbetegség erősen öröklődik. a jelző eseményeket szintén hasonlóan befolyásolják.az inzulin esetében. Az ilyen sejtes rendellenességekkel rendelkező egészséges egyének in vivo is határozottan ellenállnak az inzulinnak, magasabb az éhomi inzulin- és trigliceridszintjük, az inzulinrezisztencia-szindróma (vagy anyagcsere) számos jele mellett. Ezenkívül az a tény, hogy ezek az egyének rezisztensek voltak az inzulin in vivo glükózfelvételt stimuláló képességére az euglikémiás bilincs alatt, azt jelzi, hogy az izomfelszívódás csökkent volt, valószínűleg a glükóztranszport károsodása miatt. 34
Nem valószínű, hogy a zsírsejtekben megfigyelt molekuláris rendellenességek másodlagosak lennének az inzulinrezisztencia és a hiperinsulinémia szempontjából. Bár az IRS-1 fehérje csökkenthető hosszú távú és súlyos hiperinsulinémiával in vitro, 35 sok elhízott egyénnek volt hiperinsulinémiája és normális IRS-1 expressziója is. A csökkent GLUT4 kifejezés nem magyarázható ezzel a lehetőséggel.
Mint fent említettük, a 2-es típusú cukorbetegségben az izomban a fő következetes megállapítás rendellenességnek tűnik (gyorsan reverzibilis?) Az inzulin-stimulált glükóztranszportban és a glikogénszintézisben, míg a PKB/Akt aktiváció normális. Bár ez nem zárja ki az izom inzulinhatásának más, még meghatározatlan molekuláris célpontjainál tapasztalható jelentős rendellenességeket, például a c-Cbl-asszociált fehérjét (CAP), 36 az is egyértelmű, hogy ebben nagy különbségek vannak a zsír és az izom között. tekintettel. Így az IRS-1 alacsony expressziója adipocitákban az inzulinrezisztencia biomarkere és a 2-es típusú cukorbetegségre való hajlam. 28.
A kulcskérdés tehát az, hogy miért vannak ezek a különbségek az inzulinjelzésben, valamint a gén és fehérje expressziójában a két fő inzulin célszövet között. Bár erre nincsenek határozott válaszok, az egyik lehetőség az, hogy a zsírszövet elindítja és/vagy az a kezdeti szövet, ahol az inzulinrezisztencia kialakul. Ez akkor olyan eseménysorozathoz vezethet, amelyben az izmokban és a májban inzulinrezisztencia indukálódik vagy növekszik.
Az egyik lehetőség az, hogy az IRS-1 és a GLUT4 csökkent expressziója a zsírsejtekben az inzulinérzékenység csökkenéséhez vezet az egész testben. Mint fentebb említettük, nem valószínű, hogy a viszonylag alacsony zsírszint-glükóz bevitel csökkenése (
Nemrégiben azt találták, hogy a zsírszövet kiválaszt egy másik peptidet, a rezisztint 40, amely összefüggésben lehet az elhízás inzulinrezisztenciájával. Hasonló, FIZZ141 nevű fehérjét korábban izoláltak gyulladásos sejtekből, kísérletileg kiváltott asztmával rendelkező állatok tüdőmosása során. Az ellenállás általános szerepe azonban az emberi inzulinrezisztenciában sejtésszerű. Két újabb kutatás nem tudta kimutatni a rezisztin expresszióját az emberi zsírsejtekben 42, 43, függetlenül az elhízás mértékétől 42 vagy az inzulinrezisztenciától. 43
Egy másik lehetőség az, hogy az IRS-1 és a GLUT4 alacsony expressziója az adipocytákban a lipolízis és a keringő FFA fokozott szintjével jár, ami viszont in vivo rontja az inzulin hatást. Azonban az éhomi FFA-szint ezeknél az egyéneknél nem különbözik azoktól a gondosan illeszkedő egyénekétől, akiknél ezek a fehérjék normál expresszióval rendelkeznek, de az inzulin FFA-szint csökkentésére való képessége várhatóan romlik.
Bár sok bizonyíték támasztja alá az endokrin keresztátvitelt a zsír és az izom (és a máj?) Között, jelenleg nem világos, hogy egy ilyen mechanizmus miként magyarázhatja azt a tényt, hogy a lipoatrophia az inzulinrezisztenciával és a cukorbetegséggel is összefügg. A lipoatrophia egyik állatmodelljében kiderült, hogy az inzulinrezisztencia valószínűleg a leptinhiánynak köszönhető. A leptin beadása ezeknek az állatoknak jelentősen javította az inzulinérzékenységet, feltehetően a feleslegben felhalmozódott lipidek izomban és más szövetekben történő fokozott oxidációjának köszönhetően. Ezzel szemben a totális lipoatrophia másik állatmodelljében a leptin nem volt képes javítani az inzulinrezisztenciát, de a zsírátültetés jelentős javuláshoz vezetett. 46
Így a zsírszövet nemcsak peptideket termel, amelyek inzulinrezisztenciát indukálhatnak, hanem olyan hormonokat is, amelyek fokozhatják az inzulinrezisztenciát, mint például a leptin 45 és az adiponektin. 47, 48, 49 A keringő adiponektin szintek pozitívan korrelálnak az inzulinérzékenységgel és negatívan kapcsolódnak a BMI-hez. Ezenkívül az adiponektin beadása az inzulinrezisztencia és a cukorbetegség állatmodelljeiben javítja az inzulinérzékenységet. Így a zsírszöveti hormontermelés egyensúlya, amely fokozza (például az IL-6 és a TNFα) vagy enyhíti (például a leptin és az adiponektin) inzulinrezisztenciáját, valamint egyéb hatásokat, valószínűleg több tényezőnek köszönhető, beleértve a zsírtömeget tápláltsági állapota és genetikai háttere.
A tiazolidindionok hatása az IRS-1 és az IRS-2 expressziójára
A pioglitazon (10 μM) hatása az IRS-2 mRNS expressziójára 16 órán át inkubált 2-es típusú adipocita zsírsejtekben.
Teljes méretű kép
Az IRS-2 a PI3-kináz aktiválódásának fő dockfehérje az adipocitákban, amikor az IRS-1 jelentősen csökken, mint a fentiekben leírtak szerint a 2-es típusú, 17-es típusú cukorbetegségben. Hasonlóképpen, az IRS-2 fő dokkoló fehérjeként funkcionál az IRS-1 „knock-out” állatok sejtjeiben. Ezenkívül úgy tűnik, hogy az IRS-2 a májban és a 3, 53 β-sejtekben expresszálódó IRS-molekula, és ezen szervek rendellenességei szintén a 2-es típusú cukorbetegség egyik fő oka az IRS-2 'állatok kopogásában. Nemrégiben megvizsgáltuk az IRS-2 sejtszintjét ob/ob állatokban, amelyeket 6 napon át kezeltek TZD-vel, és a zsírsejtekben fokozott expressziót is találtunk (publikálatlan megfigyelés). Jelenleg azonban nem világos, hogy a TZD növeli-e az IRS-2 expresszióját az izom-, a máj- és a β-sejtekben is, de ez egy folyamatban lévő vizsgálat tárgya.
A zsírban, májban és/vagy izomban megnövekedett IRS-2 expresszió helyettesítheti az IRS-1 fehérje csökkenését és/vagy az inzulin foszforilációjának és aktivációjának zavart, ami fokozott inzulinérzékenységhez vezethet. Ezenkívül az IRS-2 expressziójának várható növekedése a β-sejtekben a TZD által fontos lehet mind a növekedés, mind a funkció szempontjából. Vonzó terápiás lehetőségnek tűnik azonban olyan szerek alkalmazása, amelyek közvetlenül növelik az IRS-1 expressziót, mivel ez a dokkoló fehérje a PI3-kináz fő aktivátora az emberi zsírsejtekben az inzulinra adott válaszként, és az IRS-2-vel ellentétben rezisztens az IRS-1-ig, az inzulin jelentősen csökkent az adipocytákban. Javasoljuk itt, hogy az IRS-1 és GLUT4 gén szövetspecifikus redukciója és fehérje expressziója fontos szerepet játszhat az egész test inzulinrezisztenciájának kialakulásában, akár közvetlenül, akár közvetve a fokozott citokintermeléssel és/vagy más inzulin-antagonista faktorokkal való összefüggés révén. (4. ábra). A TZD csillapíthatja vagy normalizálhatja ezt a hatást azáltal, hogy fokozza az IRS-2 expresszióját az adipocitákban és esetleg más inzulin és hasnyálmirigy β-sejtek célszöveteiben.
Azon események lehetséges sorrendje, amelyekben a zsírszövet inzulinrezisztenciát indukálhat.
Teljes méretű kép
Bár ez az áttekintés az inzulinjelzés korai károsodásának inzulinrezisztenciájával és az adipocitákban bekövetkező hatás csökkentésével és az IRS-1/GLUT4 expresszió csökkentésével, valamint a TZD IRS-1/IRS-2-re gyakorolt hatásával kapcsolatos legújabb megállapításokra összpontosít, a TZD egyértelműen más fontos változásokat is kivált. zsírszövetben. Ide tartozik az új és a kisebb adipociták toborzása a fokozott adipogenezis révén, amely folyamat során mind az IRS-1, mind az IRS-2 kulcsszerepet játszik, 56 megváltoztatja az inzulinhatással közvetlenül vagy közvetetten összefüggő génexpressziót, 57 beleértve az adipocita felszabadulás citokin gátlását. Ezenkívül a TNFa lipolízist és FFA felszabadulást stimuláló képességét is antagonizálja a TZD. 38
Az inzulin azonban a lipolízis szintjének és a keringő FFA szintek in vivo kulcsszabályozója, és az inzulin antilipolitikus hatását a PI3-kináz aktiváció közvetíti. Így az IRS-1 csökkent expressziója és az inzulinnal stimulált PI3-kináz aktivitás az inzulinrezisztenciát is összekapcsolja, amint azt az inzulin által stimulált glükózfelvétel csökkenti, és az inzulin képességének károsodását a lipolízis elnyomásában.
köszönöm
A szerző laboratóriumában végzett vizsgálatokat a Svéd Orvosi Kutatási Tanács (B-3506 projekt), a Svéd Diabetes Szövetség, az Európai Közösség (QLG1-CT-1999-00674), Gullan és Sven-Erik Karlsson támogatásával támogatták. a Sony Hedenbratt Emlékalap, valamint az IngaBritt és Arne Lundberg Alapítvány.
- Kollár új feleségének 6 évvel ezelőtti átalakulása nem botlott volna meg rajta, így nézett ki megapieres nélkül
- Vigyázzon a forró tűzhelyre, az éles késekre és a zuhanásokra
- Pánikbetegség és szülés
- Politick; oldaltámadás; és beleértve ziu det; kol; k; Előtt; kol; k
- A csípős paprika véd a szívroham ellen - Ember - Tudomány és technológia