elemeket
absztrakt
Az elhízás mind a fejlett, mind a fejlődő országokban globális egészségügyi probléma, amely nem hatékony stratégia annak elterjedésének megakadályozására. Az Egészségügyi Világszervezet (WHO) szerint, ha a testtömeg-index (BMI) egyenlő vagy nagyobb, mint 25 kg/m 2, akkor azt túlsúlynak tekintik, míg ha legalább 30 kg/m 2, elhízásnak tekintik 1. Az elmúlt tíz évben a népességi trendek a túlsúly vagy az elhízás terhesség előtti 40% -os növekedését, a terhesség előtti kóros elhízás kétszeres növekedését mutatják 2. Az emberi reproduktív rendszer szempontjából a magas BMI negatívan befolyásolja az endokrin rendellenességek 3, az anovuláció 4 és a petesejtek minőségének csökkenése 5 által okozott termékenységet az endometrium fogékonyságára, amely spontán abortuszt okozhat 6. Ezért egyre több reproduktív korú BMI-nek kell visszatérnie az asszisztált reproduktív technológiához (ART) meddőségének kezelése érdekében.
A friss embriótranszfer (ET) alkalmazása azonban lehetővé teheti a petefészek-stimuláció okozta méhnyálkahártya-rendellenességek fennmaradását, és befolyásolhatja az ART-nők későbbi terhességeit és szülészeti eredményeit. Megfigyelési tanulmányok pedig azt mutatták, hogy a FET csoportnál a klinikai terhesség szignifikánsan magasabb volt egy átviteli periódusnál, mint az ET 11 csoportnál. A fagyasztási technika 1996-ban jelent meg 12, majd 1999-ben feljegyezték az első petesejt-vitrifikációval történő születést 13, körülbelül 10 évvel később megjelent az első embrió-vitrifikációból eredő terhesség 14. A világon széles körben alkalmazott fagyasztási technológiát 2004 óta fontos áttörésként alkalmazzák a reproduktív biológiában. A petesejtek és embriók krioprezerválása kiváló túléléssel több mint 90% -os túlélést érhet el, és a terhesség esélye egyenértékű. azok, akiknek friss átigazolása van 15 vagy néha még jobb 16. A fagyasztott embriók átvitele nemcsak lehetővé teszi a petefészek és a kitett endometrium felépülését a petefészek stimulációjából, hanem elkerüli a magas ösztradiolszint nemkívánatos hatását az implantációra. Ezért a FET technológia növelheti az ART hatékonyságát elhízott nőknél, és az első választássá válhat.
A magas BMI-vel rendelkező nők hasonló tulajdonságokkal rendelkeznek, mint a PCOS-ban szenvedők, például az alacsonyabb progeszteronszint. Hogy a PPOS protokoll a FET-el kombinálva válhat-e adaptív terápiává a magas BMI-vel rendelkező nők számára, ami nagyon ígéretesnek és értelmesnek tűnik. Különösen megvizsgáljuk a magas BMI-vel rendelkező nők jelenlegi terápiáit, többnyire standard GnRH hosszú agonista protokollokat, GnRH fáklyás mikrodózis protokollt, GnRH antagonista protokollt, túl hosszú protokollt vagy 26, 27, 28, 29 fokozott hosszúságú protokollt, ET-ek, amelyek mindig csökkentik a terhességet és az élve születés kimeneteleit. Ezért ezt a retrospektív elemzést az oocita és a PPOS terhesség eredményeinek vizsgálatára végezzük magas FMI-vel rendelkező nők FET kezelési stratégiájával kombinálva.
az eredmény
A klinikai jellemzők és az IVF két BMI csoportot eredményez a FET technológiával
Az 1. táblázat a FET technológiát alkalmazó IVF alapvető jellemzőit és eredményeit mutatja két BMI-csoportban szenvedő betegeknél. 2212 normális BMI nő és 320 magas BMI nő (21, 28 vs. 27, 13; p 26, 27, 28, 29, bazális FSH (5, 00 vs. 5, 66, p) 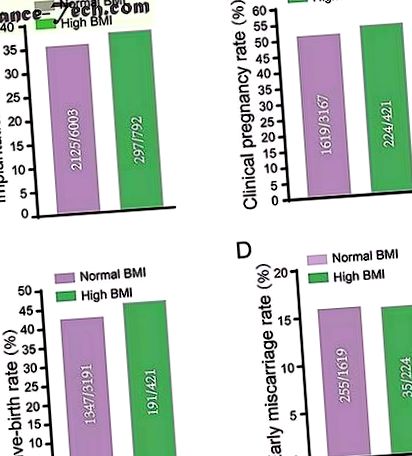
A normál BMI és a magas BMI csoportokban nem volt különbség az implantációs arányban ( A ), a klinikai terhesség B ), születési arány ( C ) és a korai abortusz aránya ( D ) után FET. A nyers adatokat az ábrák mutatják, és a Chi-négyzet próbával elemzik. A különbségeket akkor tekintettük statisztikailag szignifikánsnak, ha a p érték 0,05 alatt volt.
Teljes méretű kép
A ciklus jellemzői és a petesejt a petefészek stimulációjának három csoportját eredményezi a női BMI szerint
A FET technológiával kombinálva elemeztük három különböző petefészek-stimulációs csoportunk IVF-eredményeit: a hagyományos rövid, hMG + MPA (4 mg/d) és a hMG + MPA (10 mg/d) önmagában normál BMI-ben (18, 5 -24, 9 kg/m2) és magas BMI-csoportok (≥25 kg/m2) nőknél. A kiindulási jellemzőket, a hormonprofilokat és a betegciklus jellemzőit a 2. táblázat mutatja be. Először ugyanazon BMI-s nőknél vizsgáltuk az IVF eredményeit három különböző petefészek-stimulációs csoport felhasználásával a 2. táblázatban. A normál nők csoportjában a BMI volt a hMG időtartama. szignifikánsan hosszabb a hMG + MPA (10 mg/d) csoportban, mint a hagyományos, rövid és hMG + MPA (4 mg/d) csoportban (8, 94 vs. 8, 14 vs. 6, 87, p
Az implantációs arányok összehasonlítása ( A ), a klinikai terhességi arányok B ), születési arány C ) és a korai abortusz aránya ( D ) a petefészek-stimuláció három csoportjában a női BMI szerint FET alatt. A nyers adatokat az ábrák mutatják, és a Chi-négyzet próbával elemzik. * 26., 27., 30. o. Ezért a petesejtek minősége és az endometrium fogékonysága közötti megbeszélés, ami a fő oka annak, hogy ez továbbra is a nők magas BMI-jében marad, mint korábban. A magas BMI azonban nem befolyásolja az IVF eredményeket az elhízott nőknél, akik donor petesejteket használnak, ami azt sugallja, hogy elhízott nőknél az oocita minősége lehet a legfontosabb tényező, nem pedig az endometrium fogékonysága 10. Eredményeink azt mutatták, hogy a három petefészek-stimulációs kezelés során a magas BMI-vel (BMI ≥ 25) rendelkező BMI-csoport kezdetben csökkentette a megszerzett petesejteket, az MII-petesejteket, a megtermékenyített petesejteket, a legmagasabb minőségű embriókat és életképes embriókat, mint normál BMI-csoportot. A magas BMI-vel rendelkező nők petesejtjeinek teljesítménye megváltozott, és hasonló terhességi eredményeket ért el, mint a normál nők BMI-je. A FET alkalmazása csökkentheti a petefészek-szimuláció okozta endometrium-kudarcot.
Vizsgálatunknak korlátai is vannak. Először is, ez egy retrospektív tanulmányterv, amelyet a jövőben randomizált, kontrollált vizsgálattal kell megerősíteni. Másodszor, a vizsgálatunkban a magas BMI-csoportnak csak egy csoportja volt (BMI ≥ 25), ami jobb, ha pontosabban felosztjuk, ha elegendő ciklusa van, például túlsúlyos (BMI 25, 0-29, 0), elhízott (BMI) 30, 0–49, 9) és szuperobás (BMI> 50). Míg a hMG + MPA mindkét csoportja javította a klinikai eredményeket ebben a magas BMI-vel rendelkező csoportban, és minél több MPA-t használnak, annál jobbak az IVF eredmények. A hMG + MPA ezen két csoportjának (4 vagy 10 mg/nap) következetes és dózisfüggő terápiás hatása van a magas BMI-csoportban, ami segít megerősíteni az MPA hatását magas BMI-s nőkben. Harmadszor, a magas BMI-csoportban nem rendelkeztünk ET kontrollal, ami segít megismerni a terhességi kimenetel javulását azoknál a magas BMI-vel rendelkező nőknél, akiknél a petesejtek teljesítménye kezdetben gyenge volt, mint a normális nők BMI-je, amelyet közvetlenül FET vagy más tényezők indukáltak. annyi korábbi tanulmány kimutatta, hogy az ET alkalmazásakor a magas nők BMI-je megfigyelné ezt a kedvezőtlen teljesítményt a terhességben, mint a petesejtben.
Összegzésképpen feltételezhető, hogy a hMG + MPA (4 vagy 10 mg/d) petefészek-stimulációs protokoll FET technológiával kombinálva hatékony és elfogadható kezelés lehet magas BMI-vel (≥25) rendelkező nőknél a hagyományos rövid protokoll és nők esetében magas BMI-vel hMG + MPA (10 mg/d) a leghatékonyabb kezelési stratégia közülük háromban. Az eredmények azt sugallják, hogy a hMG + MPA protokoll (4 vagy 10 mg/d) hatékonyabb lehet, számos elméleti előnnyel, például FET-mel, amely lehetővé tenné a petefészkek és a petefészek-stimulációból kitett endometrium jobb értékelését, elkerülve ezzel a nem kívánt magas Az implantációkor alkalmazott ösztradiol és az MPA szintje részben javíthatja az oocita fejlődését, ráadásul az MPA (10 mg) jelentősen kiegészíti a progeszteronhiányt magas BMI-vel rendelkező nőknél, és valószínűbb, hogy az IVF sikeres lesz.
mód
A testtömeg-index értékelése
A súlyt és a magasságot használták a BMI kiszámításához a standard képlet alapján: BMI = súly/magasság 2 (kg/m2). A támogatható vizsgálati alanyokat a betegek BMI-jétől és az Egészségügyi Világszervezet szabványai alapján két csoportba osztották: a normál BMI-csoport (18,5 kg/m2 ≤ BMI 2) 1. A BMI-adatok pedig az egyes betegek egészségügyi nyilvántartásában mért magasságon és súlyokon alapultak.
Petefészek-stimulációs protokollok
A rövid petefészek-stimuláció szokásos protokollja
Kontrollcsoportként standard rövid távú protokollt alkalmaztunk. A betegek naponta 0,1 mg triptorelint kaptak a 2. menstruációs ciklustól (MC2) az emberi choriogonadotropin (HCG) beadásának időpontjáig, és exogén hMG-t (150-225 NE) kaptak naponta MC3-onként. 4-5 napos hMG beadás után ultrahang transzvaginális vizsgálatot és szérum hormonszint vizsgálatokat végeztek, és a hMG adagját optimálisan igazították a kialakuló tüszők száma és mérete alapján. A petesejtek érésének utolsó szakaszát hCG (Lizhu Pharmaceutical Trading Co., Zhuhai, Kína) intramuszkuláris injekciójával indukáltuk, miután a domináns tüszők elérték a 18 mm átmérőt. Ha a páciensnek háromnál több domináns tüszője volt, 2000 NE hCG-t adtak be, míg legfeljebb három domináns tüszővel rendelkező betegeknél 5000 NE hCG-t alkalmaztak a kiváltáshoz. A transzvaginális ultrahangvezérelt petesejtgyűjtést 34-36 órával később végeztük el.
PPOS protokoll
A hMG + MPA eljárás részletes leírását előző publikációnkban 17 közöljük. Röviden: a petefészek stimulációját MC3-tól kezdve kezdték meg a betegeknél 150-225 NE hMG (Anhui Fengyuan Pharmaceutical Co. Ltd., Hefei, Kína) és MPA (4 mg/nap vagy 10 mg/nap) injekcióval 17. A kezdeti 150 NE/nap adagot olyan betegeknél alkalmazták, akiknek a AFC-értéke 20 felett volt, vagy kissé megemelkedett a bazális FSH (7-10 NE/l), míg az összes többi betegnél 225 NE/nap adagot alkalmaztak. Korábbi fogamzásgátló vizsgálatok kimutatták, hogy 10 mg MPA használható az ovuláció gátlására, míg az 5 mg MPA nem gátolta az ovulációt 54, valószínűleg 10 mg MPA lehet jobb az idő előtti LH emelkedés megelőzésében egy kontrollált petefészek stimulációs környezetben. Ebben a tanulmányban 4 mg és 10 mg MPA-t választottunk az MPA optimális dózisának vizsgálatára a dózis hatékonyságának további vizsgálatához. Amikor a három domináns tüsző eléri a 18 mm átmérőt, a petesejtek érésének utolsó szakaszát együttműködtük triptorelin (0,1 mg, Decapeptyl, Ferring Pharmaceuticals) és hCG (1000 NE; Lizhu Pharmaceutical Trading Co.) SC injekcióival. Az ovocitákat transzvaginális aspirációval állítottuk elő az ovuláció után 34-36 órával.
Az IVF eredmények értékelése
A betegek IVF-kezelésen estek át, amelyet rutin laboratóriumi eljárások szerint végeztek a petesejtek visszaszerzésének napján, a fentiek szerint, 55, 56. Röviden: Flushing Medium-ot (Origio Medical Company, Dánia) használtunk petesejtek előállításához, és emberi tubális folyadékot (HTF; Irvine Scientific, CA, USA) 10% -os szérumpótló kiegészítőkkel (SSS; Irvine Scientific, CA, USA) használtunk. mint a petesejtek gyűjtésének és megtermékenyítésének közege. Az embriókat 10% -os SSS-ben tenyésztettük, folyamatos folyamatos tenyészközeggel kiegészítve (CSC; Irvine Scientific, CA, USA).
Az IVF-kezelési ciklusok 3. napjának embrióit Blastomer-szám, valamint az embrionális fragmentáció szabályossága és mértéke alapján teszteltük a Cummins-kritériumok 57 szerint. A kiváló minőségűnek tartott I. és II. Fokozatú embriókat fagyasztással megőrizték; A III. És IV. Fokozatú embriókat hosszúkás tenyészetekbe helyezték, amíg elérték a blasztociszta stádiumot, és csak a morfológiailag jó blasztocisztákat fagyasztották le az 5. vagy a 6. napon. A fagyasztott emésztési szakasz embrióinak és blasztocisztáinak vitrifikációs eljárását a Cryotopcarrier rendszer ( Kitazato). Biopharma Co.), amint azt fentebb említettük 58. A vitrifikáláshoz kriotóp hordozó rendszert használtunk 15% (v/v) etilén-glikol (EG), 15% (v/v) dimetil-szulfoxid (DMSO) és 0,5 M szacharóz krioprotektáló oldatként. 1, 0, 5 és 0 M szacharóz oldatait használtuk felolvasztáshoz a krioprotektáns fokozatos hígításához.
Endometrium előkészítése és fagyasztott embriótranszfer
Az endometrium előállítását az egyes transzmissziós ciklusok során természetes ciklusban, enyhe stimulációs ciklusban vagy hormonpótló terápiában végeztük, az előző 19., 21. cikkünkben leírtak szerint. Az embrió és az endometrium szinkronizálásának módszere a FET a következő volt: a természetes FET ciklusok esetében a tüsző növekedését szérum hormonokkal és ultrahanggal követtük nyomon a 10. napi ciklustól. Amikor az endometrium vastagsága> 8 mm és a domináns tüsző átmérője> 16 mm volt, E2-vel > 150 pg/ml és P 8 mm, a Femostont (Solvay Pharmaceuticals BV) 8 mg/nap dózisban kezdték meg. Az embriótranszfert a Femoston beadását követő harmadik napon határoztuk meg.
Az összes FET ciklusban egy vagy két felolvasztott embriót vittek át a páciens szándékának megfelelően. A terhesség elérése után az exogén ösztrogén és a progeszteron pótlása a terhesség 8-10. Hetéig folytatódott.
Statisztikai analízis
köszönöm
A szerzők köszönetet mondanak a résztvevő terméketlen nőknek, valamint a Sanghaj Jiaotong Egyetemi Iskola Kilencedik Népi Kórházának Segített Szaporodásának Tanszékén alkalmazott összes orvosnak, nővérnek és laboratóriumi alkalmazottnak. Köszönet WG segít a kézirat angol helyesírási és nyelvtani hibáinak felülvizsgálatában. Ezt a munkát támogatta a Kínai Természettudományi Alapítvány (támogatás száma: 31400970 - LW, 15411953000, 81571397 - YK) és a Sanghaji Természettudományi Alapítvány (támogatás száma: 15ZR1424900 - QL).
Hozzászólások
Megjegyzés beküldésével vállalja, hogy betartja Általános Szerződési Feltételeinket és közösségi irányelveinket. Ha ezt sértő cselekedetnek találja, amely nem felel meg feltételeinknek vagy irányelveinknek, kérjük, jelölje meg nem megfelelőnek.
