elemeket
absztrakt
A csont folyamatosan megújul azáltal, hogy a régi csontot új csontra cseréli a csont átalakításával, amely átalakulási folyamat a csontreszorbeáló sejtek (oszteoklasztok) és a csontképző sejtek (oszteoblasztok) kölcsönhatásából és egyensúlyából áll Az osteoclastok és az osteoblastok közötti potenciális egyensúlyhiány döntő szerepet játszik az osteoporosis patogenezisében.
Az ösztrogénhiány posztmenopauzás nőknél serkenti az osteoclast képződést, ami a posztmenopauzás osteoporosis kialakulásához vezet 2, 3. Becslések szerint az ösztrogénhiányos oszteoporózis az 50 év feletti nők 40% -át érinti. A jelenleg rendelkezésre álló oszteoporotikus gyógyszerek közül a posztmenopauzás ösztrogénpótló terápia bizonyította a legerősebb védőhatást a nők oszteoporózisával szemben. Sajnos a hormonpótlás alkalmazása a menopauza utáni nőknél korlátozott az emlő- és az endometrium rák hosszú távú alkalmazásának lehetséges megnövekedett kockázata miatt 5. Ezért a sejtek aktivitásának változását előidéző sejtes és molekuláris mechanizmusok megértése azonosíthatja a csontritkulás és más csonttal kapcsolatos patológiák lehetséges terápiás célpontjait.
Az oszteoklasztok differenciálatlan sejtekből származnak monocita-makrofág vonalon. Különösen két citokin stimulálja őket egyszerre: a makrofág kolónia stimuláló faktor (M-CSF) és a nukleáris faktor-kappa B ligandum receptor aktivátor (RANKL). Az M-CSF elengedhetetlen az osteoclast prekurzorok túlélése és szaporodása szempontjából, és a RANKL kulcsszerepet játszik az osteoclast differenciálódásában és aktiválásában 6. A RANKL által kiváltott RANK aktiváció az oszteoklaszt progenitor sejteken a tumor nekrózis faktor (TNF) asszociált 6 faktor (TRAF6) toborzásához vezet, ezáltal aktiválva számos downstream jelátviteli molekulát, mint például az NF-κB és a mitogén-aktivált protein kináz (MAPK). korai stádiumú oszteoklaszt differenciálódásban 7. Ez a jelátviteli kaszkád olyan fő transzkripciós faktorok aktiválásához vezet, mint az aktivált T-sejt c1 nukleáris faktor (NFATc1) és a c-fos, amely az aktivátor fehérje 1 (AP-1) 8, 9 transzkripciós faktorainak tagja 8, 9, 10 .
Anyagok és metódusok
Reagensek és antitestek
A minimális esszenciális táptalaj-alfa (α-MEM) és a szarvasmarha magzati szérumát (FBS) a Life Technologies-től (Gibco BRL, Grand Island, NY, USA) szereztük be. Rekombináns egér M-CSF-et a Miltenyi Biotec-től (Gladbach, Németország) vásároltunk. Rekombináns egér sRANKL-t a Prospec Biotec-től (Ness-Ziona, Izrael) szereztünk be. Az SB 203580, SP 600125 és PD 98059 termékeket az Enzo Life Sciences-től (AG, Svájc) vásároltuk. A 17β-ösztrogént (E2) a Sigma-Aldrich-től (St. Louis, MO, USA) szereztük be. Az ösztrogén receptor (ER) antagonistát, az ICI 182, 780-at a Tocris Bioscience-től (Bristol, Egyesült Királyság) szereztük be. A PRMT1, ASYM24, a p65, p38, az extracelluláris jelszabályozó kináz (ERK) és a c-Jun N-terminális kináz (JNK) szabályos vagy foszfó formájú antitesteket a Cell Signaling Technology-tól (Danvers, MA, USA) vásároltuk. - az aktint és a katepszin K-t a Santa Cruz Biotechnology-tól (Santa Cruz, Kalifornia, USA) szerezték be.
Osteoklasztikus differenciálás és TRAP festés
Az oszteoklasztok előállításához egér csontvelő sejteket izoláltunk 6-8 hetes egerek combjaiból (Samtako, Gyunggi-Do, Korea). A vörösvértestek lízise után a megmaradt csontvelő sejteket 3 napig 37 ° C-on inkubáltuk 5% CO 2 -ban 10% FBS-sel és 1% penicillinnel/sztreptomicinnel kiegészített α-MEM-ben M-CSF jelenlétében (30 ng/ml). A csontvelőből származó makrofágokat (BMDM) úszó sejtek eltávolításával nyertük. Adherens sejteket (BMDM) használtunk osteoclast prekurzorokként. A BMDM-eket M-CSF (30 ng/ml) és RANKL (100 ng/ml) jelenlétében tenyésztettük további 3 napig. Az osteoclast képződést tartarát-rezisztens savas foszfatáz (TRAP) festéssel határoztuk meg. 3 nap múlva a sejteket fixáló oldattal rögzítettük 30 másodpercig, és a TRAP festést kereskedelmi készlet (Sigma, MO, USA) segítségével végeztük a gyártó utasításainak megfelelően. A TRAP-pozitív, többmagos magok (MNC, háromnál több magot tartalmazó) sejtek számát fénymikroszkóppal számoltuk meg.
Állatkísérletek
A C57BL/6 háttérrel rendelkező PRMT1 haploinsufficiency (PRMT1 +/-) egereket dr. Seung-Hoi Koo (élettudományi tanszék, Koreai Egyetem, Szöul, Korea). A vad típusú (WT) egereket (PRMT1 +/+) heterozigóta PRMT1 +/- hez társították, és testvéreket alkalmaztak a genotipizálás utáni kísérletekben. Az összes egeret specifikus kórokozótól mentes állapotban, 22 ± 1 ° C hőmérsékleten, 50% páratartalom mellett helyeztük el. A 7 hetes nőstény nőstény egerek WT (n = 6) és a PRMT1 +/- (n = 6) egerek OVX-ek voltak, kétoldali petefészkeket eltávolítva dorzális megközelítéssel általános érzéstelenítésben rompun (10 mg/kg) és zoletil (30 mg) alkalmazásával./kg). A WT csoportban (n = 6) egy álműveletet hajtottak végre kétoldali petefészkek azonosításával. 8 hét elteltével az összes egeret leöltük, és combjaikat eltávolítottuk mikrokomputeres tomográfia (μCT) céljából. A TRAP vizsgálathoz a csontokat 10% -os formalinban rögzítettük, és 10% etilén-diamin-tetraecetsavban (EDTA) 10 napon át meszeltük. Valamennyi állatkísérletet a Chonnami Nemzeti Egyetem Állatok gondozásával és felhasználásával foglalkozó intézményi bizottság (IACUC) hagyott jóvá (jóváhagyási szám: CNU IACUC-YB-2016-32).
Western blot
A sejtpelleteket emlős fehérje extrakciós reagensben (Thermo, IL, USA) lizáltuk, amely proteáz inhibitor koktélt (Sigma, MO, USA) és foszfatáz I + II inhibitor koktélt (Sigma, MO, USA) tartalmazott. Minden frakcionált fehérjét a gyártó utasításainak megfelelően extraháltunk. A fehérje szinteket Bradford módszerrel számszerűsítettük. A teljes sejtkivonatokat (egyenként 30 μg) nátrium-dodecil-szulfát-poliakrilamid-gélelektroforézissel (SDS-PAGE) elválasztottuk és amplifikált nitrocellulóz-membránokra helyeztük. A membránokat ezután Tris pufferolt sóoldattal, Tween 20-mal (TBST) mostuk, 5% sovány tejjel blokkoltuk 1 órán át, és primer antitestekkel (a szállító által ajánlott hígításokkal) inkubáltuk egy éjszakán át 4 ° C-on. A membránokat ezután TBST-t és másodlagos torma-peroxidázzal konjugált antitestekkel inkubáljuk 2 órán át szobahőmérsékleten. A sávokat egy lumineszcens képelemző (ImageQuant LAS 4000, GE Healthcare, Egyesült Királyság) segítségével jelenítettük meg, Amersham ECLTM Western Blotting Detgents Reagens (GE Healthcare, UK) alkalmazásával.
Csontreszorpciós és aktingyűrűs festési tesztek
A csontreszorpciós vizsgálathoz a BMDM-eket 4 napig tenyésztettük M-CSF-mel (30 ng/ml) RANKL (100 ng/ml) jelenlétében vagy hiányában Osteo-vizsgálati lemezen (Corning Inc., NY). A reszorpciós rések számszerűsítése érdekében a sejteket 20% SDS-sel eltávolítottuk, majd desztillált vízzel alaposan mostuk és levegőn szárítottuk. A lemezeken felszívódott területeket mikroszkóp alatt (Eclipse Ni-U, Nikon, Japán) figyeltük meg. Az oszteoklaszt-szerű sejtek aktinkarikájának képződésének értékeléséhez érett BMDM-oszteoklasztokat készítettünk M-CSF (30 ng/ml) kezeléssel RANKL (100 ng/ml) jelenlétében vagy hiányában 3 napig egy fedőüvegen. a sejteket fixáltuk és 0,2% Triton X-100/foszfáttal pufferolt sóoldattal (PBS) permeabilizáltuk, majd Alexa Fluor 594-phaloidinnal (Invitrogen) festettük. A sejteket ezután szélesztettük és a sejtmagokat 4 ', 6-diamidino-2-fenilindollal (DAPI) festettük ProLong Gold Antifade Mounting Medium-ban (Invitrogen, Carlsbad, CA, USA).
siRNS transzfekció
A PRMT1 (Santa Cruz) és a kontroll siRNS-ek (Qiagen) kis interferáló RNS-eit (siRNS-eket) használták az endogén PRMT1-expresszió elnémítására. Minden siRNS-t (50 nM) transzfektáltunk BMDM-be LipofectamineTM RNAiMAX reagenssel (Carlsbad, CA, USA) az előremenő transzfekciós módszer után, a gyártó utasításainak megfelelően.
Valós idejű láncreakció (qPCR)
A teljes RNS-t a sejtekből extraháltuk TRIzol alkalmazásával, a fenol és a guanidin izotiocianát egyfázisú oldatával, amelyet az Invitrogen (Carlsbad, CA, USA) vásárolt. Ezután 1 μg RNS-t fordítottunk át komplementer DNS-be (cDNS) az RT Premix reverz transzkripciós rendszer (AccuPower, Szöul, Korea) felhasználásával oligo-dT18 primerekkel. Ezután a qPCR-t cDNS-t alkalmaztuk templátként a Power SYBR Green (Applied Biosystems, Warrington, Egyesült Királyság) alkalmazásával. A következő primereket alkalmaztuk: PRMT1, 5'-CCTCACATACCGCAACTCCA-3 'és 5'-CATCCAGCACCACCTTGTCT-3'; c-fos, 5'-CCAGTCAAGAGCATCAGCAA-3 'és 5'-AAGTAGTGCAGCCGGAGTA-3'; NFATc1, 5'-CTCGAAAGACAGTGGAGCAT-3 'és 5'-CGGCTGCCTTCCGTCTCATAG-3'; TRAP, 5'-CTGGAGTGCACGATGCCAGCGACA-3 'és 5'-TCCGTGCTCGGCGATGGACCAGA-3'; katepszin K, 5'-GGCCAACTCAAGAAGAAAAC-3 'és 5'-GTGCTTGCTTCCCTTCTGG-3'; DC STAMP, 5'-CCAAGGAGTCGTCCATGATT-3 'és 5'-GGCTGCTTTGATCGTTTCTC-3'; és p-aktin, 5'-AGGCCCAGAGCAAGAGAG-3 'és 5'-TCAACATGATCTGGGTCATC-3'. A QPCR-adatokat normalizáltuk endogén kontrollként a β-aktint használva. A valós idejű PCR-t Rotor-Gene Q valós idejű PCR-rendszeren (Qiagen, Hilden, Németország) végeztük kétlépcsős 95 ° C-os protokoll alkalmazásával 10 másodpercig, majd 40 ciklust 60 ° C-on 60 másodpercig.
Enzim immunvizsgálat (ELISA)
Az ADMA koncentrációját a tenyészet felülúszójában ultrahangos ELISA készlet segítségével (Eagle Biosciences, Nashua, NH, USA) mértük a gyártó utasításainak megfelelően.
Immunfluoreszcencia és konfokális mikroszkópia
A sejteket kétszer PBS-ben mostuk és 10 percig fixáltuk 4% paraformaldehiddel PBS-ben. Három PBS-ben végzett mosás után a rögzített sejteket 0,2% Triton X-100-val permeabilizáltuk, és blokkoláshoz 1% szarvasmarha-szérumalbumin-oldatot használtunk. A sejteket PRMT1 antitesttel (1: 100 hígítási arány) inkubáltuk 15 órán át 4 ° C-on. Három PBS-ben végzett mosás után a sejteket szekunder antitesttel inkubáltuk nyúl fluoreszcein-izotiocianát (FITC) ellen (Sigma, MO, USA). A sejteket ezután tárgylemezekre helyeztük, és a sejtmagokat DAPI segítségével vizualizáltuk. Az immunfluoreszcens képalkotást Leica TCS SP5 AOBS lézeres letapogató mikroszkóppal (Leica Microsystems, Heidelberg, Németország) végeztük Leica 63 × olaj célpont (NA 1, 4) segítségével, a koreai Gwangju Központban. A gerjesztést (496 és 405 nm) és az emissziót (500 - 535, 449 - 461 nm) figyeltük meg a FITC-konjugált konstrukció és a DAPI esetében. Valamennyi kísérlet esetében az expozíciós idő minden minta esetében azonos volt.
Luciferáz-vizsgálat
A luciferáz assay-hez a Raw 264.7 makrofágokat átmenetileg kotranszfektáltuk pGL4.32-luc2P/NF-KB-RE (Promega, WI, USA) és kontroll vagy PRMT1 segítségével β-galaktozidáz expressziós vektorral a riporter gén expressziójának normalizálása céljából Lipofectamine 3000 ( Invitrogen, Carlsbad, Kalifornia, USA). 48 órával a transzfekció után a táptalajt RANKL-tartalmú táptalajjal helyettesítettük, majd 24 órán át inkubáltuk. A sejteket passzív lizációs pufferrel lizáltuk. A promóter aktivitást luciferin bogárral és GLOMAX luminométerrel mértük. A luciferáz aktivitás mérésére szolgáló reagenseket a Promega cégtől vásároltuk.
Immuncsapadék
A RAW 264,7 sejteket 24 órán át RANKL-lel (100 ng/ml) vagy anélkül inkubáltuk M-CSF (30 ng/ml) jelenlétében. A sejteket 20 mM Tris (pH 7,4), 150 mM NaCl, 1% NP-40, 1 mM EDTA és 5% glicerin tartalmú, nem denaturáló lízispufferben lizáltuk. Ezután 200 μg fehérjét inkubáltunk PRMT1 antitesttel és 40 μl fehérje agaróz G-t nem denaturáló körülmények között 24 órán át 4 ° C-on. Az immunprecipitátumokat alaposan mossuk, kétszer minta-pufferben szuszpendáljuk, 7 percig forraljuk és immunfoltot készítünk.
μCT elemzés
Nagy távolságú Skyscan 1076 rendszert alkalmaztunk a distalis combcsontok μCT-jének leképezéséhez. A nyers képeket sorozatos keresztmetszetű képekké alakítottuk át, azonos küszöbértékekkel az összes mintához a Image Reconstruction Software 3.1-es verziójával. A tobozlemez 80 lépésétől kezdődően a proximális combcsont trabekuláris csontjainak összesen 240 lépését azonosították manuálisan érdekes területekként. A comb morfometriai paramétereit adatelemző szoftver (CTAn) segítségével határoztuk meg. A trabecularis morfometriát a szöveti térfogatonként mért csontmennyiség (BV/TV), a trabecularis szám (Tb. N), a trabecularis vastagság (Tb. Th) és a csont ásványi sűrűség (BMD) mérésével jellemeztük.
Statisztikai analízis
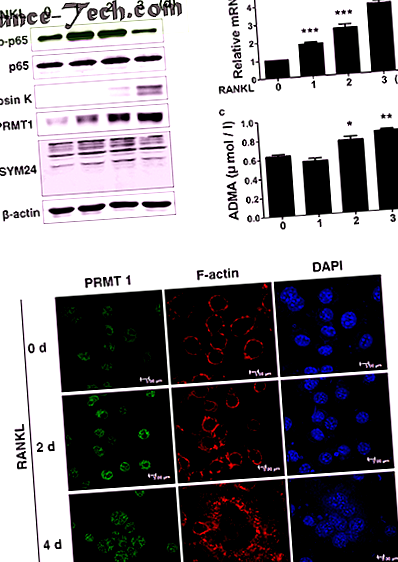
Az összes statisztikai elemzést a GraphPad Prism 5 (GraphPad, La Jolla, CA, USA) alkalmazásával határoztuk meg. A statisztikai értékeket Student t-próbájával számítottuk ki, hogy összehasonlítsuk a két csoport átlagát. Az egyirányú varianciaanalízist (ANOVA) Tukey post-hoc tesztjével alkalmazták a több érték közötti különbségek összehasonlítására az egyes csoportok közötti különbségek értékelésére. Az eredmény statisztikailag szignifikánsnak tekinthető, ha a P értéke 25, 26. Nevezetesen a PRMT1 és az ADMA fehérje szintje emelkedett a RANKL kezelésre adott válaszként az oszteoklaszt differenciálódása során (1a. Ábra). A tenyészet felülúszójában a PRMT1 mRNS expressziós szintje és az ADMA koncentrációja is megnőtt a differenciált RANKL-kezelt sejtekben (Lb, c ábra). Amint az a 2. ábrán látható. Az 1. ábrán az M-CSF és a RANKL kezelése indukált jól definiált F-aktin gyűrűképződést, amely összefügg az oszteoklasztok csontfelülethez való kapcsolódásával, és ez a PRMT1 expressziójának növekedésével jár együtt a magban.
hirdetés A BMDM-eket M-CSF-sel (30 ng/ml) és RANKL-lel (100 ng/ml) tenyésztettük a megadott időtartamokig, hogy érett oszteoklasztokká differenciálódást indukáljanak. Sejtfehérjéket extraháltunk és Western-blotot adtunk a jelzett antitestekkel. b Valós idejű PCR eredmények, amelyek a PRMT1 mRNS expressziós szintjét mutatják. Az eredményeket a β-aktin expresszió szintjére normalizáltuk. c Az ADMA expressziós szintje a tenyészet felülúszójában, ELISA-val meghatározva. Az eredményeket átlag ± SD-ként fejezzük ki. * o
A RAW 264,7 sejteket kontroll vagy PRMT1 siRNS-sel transzfektáltuk a forward transzfekciós módszer szerint. 24 óra elteltével a sejteket pGL4.32 - luc2P/NF-KB-RE és β-galaktozidáz plazmidokkal transzfektáltuk. 24 órás transzfekció után a sejteket 24 órán át RANKL-vel (100 ng/ml) kezeltük M-CSF (30 ng/ml) jelenlétében, majd passzív lizációs pufferrel lizáltuk luciferáz-vizsgálat céljából. Megmértük a luciferáz aktivitást és normalizáltuk a β-galaktozidáz aktivitásra. Az adatokat átlag ± SD-ként adjuk meg. *** p +/-. Nyolc héttel az OVX után hisztomorfometrikus és μCT elemzéseket végeztek a distalis combcsont trabekuláris csontján. A combcsont sagittalis hisztomorfológiai paraffin szakaszát TRAP festéssel vetettük alá. Az oszteoklasztikus aktivitás szignifikánsan megnőtt a WT OVX egerek metafízisében, a PRMT1 +/- OVX egereknél azonban nem (6a. Ábra). A mikro-CT morfometriai elemzése azt mutatta, hogy az OVX a BMD, BV/TV, Tb jelentős csökkenéséhez vezetett. N és Tb. Th WT egerekben (6b. Ábra, c). Az ilyen redukciókat azonban megfordították a PRMT1 +/- OVX egereknél (6b, c ábra). Ezek az eredmények azt mutatják, hogy a PRMT1 hiány megvédheti az egereket az OVX által kiváltott csontvesztéstől.
A distalis combcsontok TRAP festését leukocita savas foszfatáz készletek alkalmazásával végeztük és mikroszkóp alatt figyeltük meg (nyíl). b A combcsontok reprezentatív kétdimenziós képei láthatók. c A szöveti térfogatra jutó csontmennyiséget (BV/TV), a trabekuláris számot (Tb. N), a trabekuláris cső vastagságát (Tb. Th) és a csont ásványi sűrűségét (BMD) μCT mérésekből (n = 6) határoztuk meg. * A p +/- OVX egerek elnyomják az oszteoklaszt aktivitást és a csontvesztést, és hogy az E2 stimuláció elegendő a RANKL 30 oszteoklaszt differenciálódás blokkolásához, azt is megvizsgáltuk, hogy vajon befolyásolhatja-e a PRMT1 expressziót az 17β-ösztrogén (E2) az oszteoklaszt differenciálódása során in vitro. A BMDM-eket előkezeltük E2-vel, majd RANKL és PRMT1 fehérjével kezeltük, és meghatároztuk a PRMT1 mRNS szintjét. Az eredmények azt mutatták, hogy a RANKL által közvetített génexpressziót és a PRMT1 fehérje expresszió szintjét elnyomta az E2 kezelés BMDM-ben (7a., B. Ábra). Emellett az ICI 182, 780, ER antagonista, megszüntette az E2 PRMT1 expresszióra gyakorolt gátló hatását (7c. Ábra, d). Ezek a megállapítások azt sugallják, hogy az E2 a PRMT1 expresszió csökkentésével védőhatással bírhat az osteoporosis ellen.
a, b A BMDM-eket 2 órán át E2-vel (1 μM) vagy anélkül előkezeltük, majd 24 órán át RANKL-vel (100 ng/ml) kezeltük. A PRMT1 fehérje expresszióját Western-blot módszerrel vizsgáltuk. b A PRMT1 mRNS szintjét valós idejű PCR-rel mértük, majd β-aktin szintre normalizáltuk. c, A BMDM-eket E2-vel (1 μM) előkezeltük ICI 182, 780 (10 μM) előkezeléssel vagy anélkül. 2 óra múlva a sejteket 24 órán át RANKL-vel (100 ng/ml) kezeltük. A fehérjéket kivontuk és Western blot elemzésnek vetettük alá PRMT1 és β-aktin antitestekkel. Az adatokat átlag ± SD-ként adjuk meg. * p +/-) egerek, és ezek az eredmények arra utalnak, hogy a PRMT1 hozzájárulhat az osteoclast differenciálódásához és az osteoporosishoz.
Korábbi tanulmányok bizonyítékot szolgáltattak arra, hogy az ADMA, a PRMT 1-es típusú termék részt vehet az oszteoporózis kialakulásában. Kanazawa és mtsai. beszámol arról, hogy cukorbetegeknél a szérum dimetilarginin szintje csigolyatörések jelenlétével függ össze 31. Lu és mtsai. kimutatta, hogy a szérum ADMA szintjének növekedése a korral összefüggő patkány BMD32 csökkenésével jár. Ebben a tanulmányban azt tapasztaltuk, hogy az ADMA szintek növekedtek a sejttenyésztő táptalajban a RANKL által kiváltott oszteoklaszt differenciálódás során. Bár számos tanulmány arról számolt be, hogy az ADMA különféle anyagcsere-betegségekhez kapcsolódik 33, 34, további vizsgálatokra van szükség az ADMA pontos szerepének feltárására az oszteoklasztok differenciálódásában és az oszteoporózisban. Ezenkívül tisztázniuk kell az ADMA-szint klinikai jelentőségét osteoporosisban szenvedő betegeknél.
Végül eredményeink azt mutatták, hogy a PRMT1 expressziója megnőtt az RDMKL-kezelt BMDM magban JNK által közvetített jelátviteli útvonalon keresztül (7e. Ábra). A PRMT1 elengedhetetlen volt a RANKL által kiváltott oszteoklaszt-aktivitáshoz, a csontreszorpcióhoz és az oszteoklasztogenezissel kapcsolatos gének szabályozásához. Ezenkívül a PRMT1 hiány csökkentette az in vivo oszteoklaszt aktivitást és a csontvesztést OVX egerekben. Így a PRMT1 terápiás célpont lehet az oszteoporózis kialakulásának és progressziójának kezelésében.
köszönöm
Ezt a tanulmányt a Nemzeti Kutatási Alapítvány (NRF) támogatásával (2017R1D1A1A02019106) támogatták, amelyet a koreai kormány finanszírozott.
- Az endometriózis hozzájárul az Unilabs nők vonzerejéhez
- A traf3 specifikus deléciója a b limfocitákban a b-limfóma kialakulásához vezet egerekben - leukémia
- Az egészségbiztosító hozzájárul a gluténmentes étrendhez Ha igen, akkor melyik; Gazdasági találkozó
- Csökken a teljesítmény és a fáradtság Élete veszélybe kerülhet
- PELION - Magyarország - Tapolca - legalacsonyabb ár 0 € -tól - HELLAS TRAVEL