elemeket
absztrakt
9-11 nm) pórusátmérővel
Eredmények és értékelésük
Az Ang II és a lizenin csatornák közötti kölcsönhatás növeli az ionáram tranziens változását
Az Ang II és az egyes lizenincsatornák közötti kölcsönhatások elemzésének alapkísérleti beállításait, amely a makromolekulák transzlokációs vizsgálataiban gyakori, a Módszerek szakasz részletesen leírja. Egyetlen lizenin csatorna behelyezését a membránba állandó nyitott áram jelezte
-122 pA -60 mV torzítási potenciálnál (La ábra), amely után a cisz-tartályban lévő oldatot lizin-mentes elektrolittá cserélték, hogy megakadályozzák a további beillesztést. A puffercsere után azonban több csatorna is beilleszthető, mivel a membránhoz rögzített előpórusok képződése a 36 csatorna oligomerizációjának feltétele. Noha nem észleltünk változásokat az egycsatornás mérésekből származó jellemző elektronikus aláírásokban akár hat beágyazott nanoport esetében (ami után az elektromos zaj jelentőssé válhat, és megakadályozhatja a pontos elemzést), az egyes csatornákon végzett összes transzlokációs kísérlet következetesen két lizenin nanopórust tartalmazott, amelyek egy lipidmembrán.
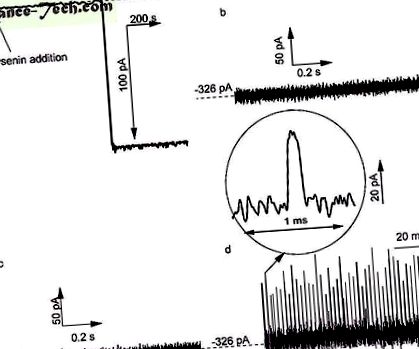
Az Ang II kölcsönhatása egyetlen lizincsatornával, amely lipidmembránokba van ágyazva, 1 M KCl-oldatokkal 10 mM Tris-sel és 1 mM EDTA-val pufferelve, pH = 6,9. a ) Egy csatorna bevezetését a kétrétegű membránba az ionáram lépésbeli változásaként figyelték meg -60 mV transzmembránpotenciálnál (mintavételi idő 1 s, 1 kHz aluláteresztő hardverszűrő és 10 Hz aluláteresztő szoftver szűrő). . A két nyitott lizincsatornán keresztül meghatározott ionáramban nem tapasztaltunk átmeneti változásokat -80 mV nyomáson, amikor: b ) az oldathoz nem adtak Ang II-t és ( c ) Az Ang II-t hozzáadtuk a transztartályhoz. ( d ) Az Ang II hozzáadása a cisz-tározóhoz több átmeneti változást eredményezett az ionáramban, jelezve a csatorna-peptid kölcsönhatásokat. A paneleken látható nyomok ( b - d ) 4 μs mintavételi idővel és 10 kHz-es aluláteresztő hardverszűrővel rögzítettük.
Teljes méretű kép
A külső oldatokhoz hozzáadott Ang II peptidanalízis hiányában a két csatornán -80 mV-on és nagy időfelbontással (4 μs mintavételi idő) rögzített ionáram azt mutatta, hogy nincs átmeneti változás a nyitott áram nyomában (ábra (1b. Ábra) és alacsony zajszint (1 Ang II a transztartályba (színpad) az egyébként azonos kísérleti körülmények és időtartomány érdekében (1c. Ábra), jelezve, hogy az elektromos mező egy bizonyos iránya megakadályozza a nanorész-analit kölcsönhatásait. Ezzel szemben a peptid hozzáadása a cisz-tartályhoz -80 mV transzmembránpotenciálnál gyakori és rövid átmeneti változásokat eredményezett az ionáramban (1d. ábra), ami jelzi a peptid kölcsönhatását a nyitott 13, 14, 15, 16, 42, 43 44, 45 csatornával, 46 .
A rögzített események két fő típusa elmozdulásoknak vagy ütközéseknek sorolható
Az ionos áram hirtelen és átmeneti változásai, amelyeket az Ang II cisz oldalához történő hozzáadása vált ki, hasonlóak a többi biológiai nanopórusokkal kölcsönhatásba lépő peptidek elektronikus aláírásához (11, 14, 16, 43, 44, 45, 46). A Transalyzer 47 szoftvercsomaggal végzett elektronikus tranziens aláírás mélyreható elemzését minden egyes eseménynél elvégeztük a tranziens reteszelés alatti átlagos áramváltozás és a várakozási idő, tD szempontjából. A -80 mV-nál rögzített eseménysűrűség grafikonja (2a. Ábra) két klasztert mutatott, ez a jelenség gyakori jelenség a 11, 14, 43, 48 szintetikus és természetes nanopórusokon áttelepített makromolekulák esetében. A két klaszter jelenléte a peptidcsatornák különböző szignál kölcsönhatásaira utal, amelyek a 7 nanopórusba belépő, hajtogatható, 11 oligomerizáló, 46 kötődésű vagy sikertelen transzlokációs kísérletek ellentétes orientációját jelenthetik, ha a molekulák csak a 14 csatorna nyílásával ütköznek., 43. Ábrán látható klaszterek A 2a. Ábrák különböznek egymástól, ezért könnyen felosztható két eseményosztályra, az úgynevezett E1 és E2. Az egyes osztályokhoz tartozó események további elemzése viszonylag keskeny és szimmetrikus eloszlást mutatott (2b. Ábra), csúcsa -26 pA (E1 események) és -10 pA (E2 események).
Az Ang II-nek a cisz-tározóhoz való hozzáadása után rögzített blokkoló események elemzése -80 mV transzmembránpotenciál mellett. ( a ) A sűrűséggrafikon két jól definiált klasztert mutat (E1 és E2), amelyek lehetővé tették az egyes klaszterek külön elemzését. A szín a beillesztett skála szerinti sűrűséget jelzi. ( b ) hisztogramjai (a tartály szélessége 3 pA) -26 pA (E1 események) és -10 pA (E2 események) csúcsokat képviselnek. ( c ) Az események megoszlását a két klaszter számára a tD szempontjából hisztogramok (verem szélessége 0,02 ms) képviselik
70 µs (E1 események) a
120 µs (E2 események). Az egymást átfedő eloszlások jobb megfigyelése érdekében bevezettek egy rést az E2 eseménytartályok között. Az elemzett eseményeket egy transzlokációs kísérletből gyűjtöttük össze.
Teljes méretű kép
vagy az E1, vagy az E2 események leírása a nyílt áram abszolút értékének kevesebb, mint 25% -át teszi ki, ami sokkal kisebb mennyiség, mint a peptidek vagy rövid polinukleotidok transzlokációját vizsgáló kísérletekből származó mérések során, más biológiai nanopórusok között 8, 14, 16, 4349. Ez az eltérés mind a csatorna, mind a peptid szerkezeti tulajdonságainak tulajdonítható. A 35, 36 lizenin nemrégiben közzétett szerkezete mutatja a csatorna hosszát
A két klaszter tD-eloszlása (2c. Ábra) -80 mV-on rögzítve ferde és aszimmetrikus, csúcsa
70 µs (E1 események) a
120 µs (E2 események). A jelenlegi jól elkülönített blokkeloszlásoktól eltérően a két típusú esemény t Ds jellemzői között nagy átfedést figyeltünk meg. Ezenkívül az E1 események a tD szűk eloszlását mutatták, míg az E2 események meghaladták a 0,02 ms és 0,4 ms közötti tartományt (2c. Ábra). Az α-HL vagy aerolizin csatornákon át transzlokált peptidek vagy rövid oligonukleotidok korábbi ts mérései olyan eloszlásokat mutatnak be, amelyek követik a jellemző relaxációs idők által leírt exponenciális bomlásokat az átlagos Tn 11, 13, 14, 16, 43, 46, 49 mértékeként. Eredményeink esetleg nem felelnek meg egy ilyen leírásnak, mivel a két eseményosztály egyikét sem lehet pontosan leírni az exponenciális bomlások kombinációjaként.
Az egyes lizenincsatornák és az Ang II közötti kölcsönhatások stresszfüggése. ( a ) Az E1 események átlaga (nyitott négyzetek) követte a lineárisan alkalmazott feszültséget, ahogy azt a transzlokációknál vártuk. Ezzel szemben az alkalmazott feszültség sokkal kisebb hatással volt az E2 (szilárd négyzetek) eseményeket jellemző áramzárásra. ( b ) Az átmeneti elzáródások átlagos t D értéke csökkent az alkalmazott feszültséggel az E1 (nyitott négyzetek) és az E2 (szilárd négyzetek) eseményekre. Az adatokat mindkét panelen átlag ± sd-ben fejezzük ki, n = 3; minden minta mérete legalább 2800 eseményből állt.
Teljes méretű kép
Ahogy korábban értelmeztük, olyan eseményeket rendeltünk be, amelyek kevesebb áram blokkolással és hosszabb interakciós idővel jellemezhetők, és amelyek olyan molekulákat tartalmaznak, amelyek a pórusokba ütköznek és diffundálnak 14, 43. Ezzel szemben a nagyobb áramblokádokat és a rövidebb időket tekintették jellemzőnek a feltételezett transzlokációkra 14, 43. Ennek eredményeként arra a következtetésre jutunk, hogy az E1 események a transzlokált molekulákra jellemzőek, az E2 események pedig a pórusokkal való ütközéseket jelentik. Azonban nem zárhatjuk ki teljesen a klaszterezés lehetőségét. A 2a. Ábra az 52 pórusokba belépő molekulák különböző orientációiból, a peptid hajtogatásából vagy a lizéncsatornák és a 46 peptidek közötti egyéb komplex intermolekuláris interakciókból származik. A nanorészecskéken áthaladó peptidek elektronikus aláírása nagymértékben függ az analit és a nanopórus természetétől, ami megnehezíti az olyan transzlokációs kísérletek összehasonlítását, amelyeknél egyik sem azonos.
Továbbá megvizsgáltuk az alkalmazott feszültség hatását az események gyakoriságára két különböző populációban. Amint az a 2. ábrán látható. A 4. ábra szerint az E1 vagy E2 események gyakorisága kvázi-lineárisan nőtt a transzmembrán feszültség amplitúdójának növekedésével, amit korábban a rövid, 8, 13 nukleotidok vagy peptidek transzlokációjában figyeltünk meg. A kísérleti frekvenciaértékek széles eloszlása, amelyet a nagy hibatartományok mutatnak, az Ang II hozzáadása után az oldatok egyenetlen keveredésével magyarázható. Megfigyeltük azt is, hogy az események gyakorisága idővel nőtt, ami a peptidek elektromosan vezetett felhalmozódásával magyarázható a csatorna nyílása közelében. Érdemes megjegyezni, hogy a számok viszonylag egyenletesen oszlottak meg a két populáció között, függetlenül az alkalmazott feszültségtől.
A feszültség hatása az eseményfrekvenciára. Esemény gyakorisága E1 ( a ) és E2 ( b ), amelyet egyetlen lizincsatornára becsülünk, kvázi-lineáris módon követi az alkalmazott feszültséget. A kísérleti pontok az átlag ± sd, n = 3 értéket képviselik.
Teljes méretű kép
A transzlokáció bizonyítéka: LC-MS elemzés
22 700). a módszerekről szóló szakaszban leírtak szerint).
Miután hozzáadtuk az Ang II-t a cisz-tartályhoz (végkoncentráció 10 μg ml -1) -100 mV nyomáson körülbelül 36 órán át, az oldatot további elemzés céljából eltávolítottuk a transz-tartályból. Az LC-MS kimutatta az Ang II jelenlétét a standard mintában és a transztartályból vett oldatban (5a-d. Ábra), jelezve az Ang II áthaladását a lizén-csatornák nagy populációját tartalmazó membránon. Az Ang II áttelepített mennyisége (
A transzlokációs frekvencia kiszámításához a standard mennyiségek MS-LC kalibrációs görbéjéből becsült 0,8 ng értéket használtuk
Az Ang II transzlokáció bizonyítéka sík lipidmembránba ágyazott lizenin csatornák nagy populációin keresztül. ( a ) Az Ang II összehasonlító oldat MS-je (100 ng) azonosította a peptidet m/z = 349,5 (z = 3+) értéknél. b ) Az Ang II összehasonlító oldat LC kromatogramja. -100 mV nyomáson 36 órán át transz-tartályba transzlokált peptidmolekulákat detektáltunk és azonosítottunk MS-vel ( c ) és LC ( d ). +100 mV feszültség alkalmazás ( e ) vagy kitozáncsatorna-blokkolás ( f ) nem tette lehetővé az Ang II LC transz-tartályba történő kimutatását.
Teljes méretű kép
Azt állíthatjuk, hogy a fenti kísérleti körülmények között az ellentétes elektromos tér is megakadályozhatja a transzlokációt a szivárgó membránon, vagy hogy a lizenincsatornák feszültség-kaput mutathatnak, elfogadva a szubvezetõ állapotokat 41, amelynek jellemzõje a csökkent vezetõútátmérõ, amely nem kompatibilis a nagy molekulákkal áttelepítés. Ezért egy hasonló kísérletet hajtottunk végre, amelyben a membránt -100 mV-rel eltérítettük (a transzlokáció elősegítése érdekében), de a lizenin-csatornákat kitozánnak tettük ki, amely az 58-as lizenin-csatorna irreverzibilis vezetőképesség-blokkolója. A transztartályból kivont minták LC elemzése nem mutatta az Ang II jelenlétét (5f. Ábra). Bár lehetséges, hogy spontán Ang II transzlokáció az LC-MS kimutatási határérték alatti szinteken történt, egyértelmű, hogy a membránba helyezett nyílt lizenin csatornák voltak felelősek az ebben a vizsgálatban megfigyelt elektroforetikusan szabályozott Ang II transzlokáció közvetítéséért. Az egyes lizenincsatornákon a peptid jelenlétében rögzített elektronikus aláírással együtt munkánk bizonyítja, hogy a lizenincsatornák lehetővé teszik, hogy a peptid átjutjon a membránon a nanorész vezető útján keresztül.
következtetések
Sikeresen bebizonyítottuk, hogy a lipidmembránokba beágyazott lizincsatornák megkönnyítik az elektromos mezők által elektroforetikusan vezérelt peptidmolekulák transzlokációját. Ez a tanulmány a lizenint felveszi az ígéretes pórusképző fehérjék rövid listájába, amelyek alkalmasak a természet által inspirált érzékelő és jellemző eszközök kifejlesztésére. A csatorna nagy és egyenletes átmérője olyan molekulákat tartalmazhat, amelyek túl nagyok ahhoz, hogy más biológiai nanopormák kiszorítsák őket, ezáltal kiterjesztve más biomolekuláris analitikák nanométer-szkennelési képességeit. A továbbfejlesztett vagy akár új érzékelési képességek megvalósítása érdekében további csatornatechnika kémiai módosításokkal és hely-irányú mutagenezissel lehetséges az összeszerelt 35, 36 pórusok legújabb szerkezeti adatainak köszönhetően. Ezenkívül a lizenin csatornák szokatlan szabályozási mechanizmusokat képviselnek fizikai és kémiai ingerek, például feszültség vagy 41, 54 ligandumok által. A vezető állapot külső modulációja tovább alkalmazható a bioaktív molekulák kontrollált transzportjához a természetes és mesterséges lipidmembránokon, ideiglenes sejtpermeabilizációhoz, gyógyszeradagoló rendszerekhez, intelligens kapcsolókhoz és bioelektronikához.
mód
Kétrétegű lipidek előállítása Membrán előkészítés és csatornák behelyezése
Az Ang II transzlokáció kísérleti beállításának egyszerűsített vázlata. A transzmembrán feszültségek által érintett sík kétrétegű lipidmembránokba ágyazott egyes lizincsatornák megkönnyíthetik a makromolekulák elektroforetikusan vezérelt transzlokációját egy nagy vezető úton. A csatorna méretei a ref. 35.
Teljes méretű kép
A peptid transzlációja egyedi lizenin csatornákon keresztül
Az Ang II-t 1 μg ml-1 végkoncentrációban adtuk a cisz tartályhoz, majd kb. 10 másodpercig keverjük. Az átmeneti eseményeket változó hosszúságú protokollal rögzítettük 4 µs, 1 ms mintavételezési idővel az indítás előtt és után, egy 10 kHz-es hardverszűrőt, és elemzésre tároltuk a Clampfit 10.2 (Molecular Devices), a Transalyzer 47, Matlab (Mathworks) segítségével. és Origin. 8.5 (OriginLab Corporation) szoftvercsomagok. A tartózkodási időt az elemzésre kiválasztott minden egyes esemény maximális fele-maximumaként, az aktuális amplitúdókat pedig az egyes események első és utolsó lokális minimumának 47 átlagos átlagaként számoltuk. Ez az eljárás biztosította a legjobb elkülönítést az E1 és E2 események között.
A lizincsatornák nagy populációinak beillesztése
A több csatorna kétrétegbe történő behelyezésének kísérleti protokollja hasonló volt az egyes csatornákhoz, de nagyobb átmérőt tartalmazott a PTFE film lyukához (
Átlagosan 180 μm a csatornák nagyobb populációinak befogadására). Nagyobb mennyiségű lizint adtak a cisz tartályhoz (legfeljebb 20 μl 1 μM-ig), és kisebb mennyiségű elektrolitot használtak a transz-tartályban (100 μl). A beillesztett csatornák teljes számát fokozatosan növeltük a lizén fokozatos hozzáadásával, amíg állandó ionáramot el nem érünk.
-180 nA -4 mV transzmembrán feszültségen, majd a pufferolt elektrolitot megváltoztattuk, hogy a lizént eltávolítsuk az ömlesztett oldatból. A membránban lévő csatornák száma (
22 700-at) a keskeny feszültségtartományra rögzített IV görbe alapján meghatározott teljes membrán vezetőképesség (7. ábra) és a csatorna egyéni vezetőképessége (7. ábra) arányából becsültük.
IV grafikon kétrétegű lipidmembránba ágyazott lizenincsatornák nagy populációira. A beillesztett csatornák számának becsléséhez a görbe meredekségéből számított vezetőképességet használtuk.
Teljes méretű kép
A lizenin csatornák kitozán általi blokkolása. A kitozán hozzáadása állandó és irreverzibilis csökkenést okozott a makroszkopikus vezetőképességben -4 mV transzmembrán potenciálnál, ami jelzi a csatornaelzáródást.
Teljes méretű kép
LC-MS elemzés
köszönöm
Az ebben a kiadványban bemutatott kutatást az Országos Tudományos Alapítvány (támogatási számok 1554166, 0923535), az Országos Egészségügyi Intézetek (P20GM109095, P20GM103408 támogatási számok) és az Országos Repülési és Űrhivatal (NNX15AU64H támogatásszám) támogatták. A tartalom kizárólag a szerzők felelőssége, és nem feltétlenül képviseli a segélyügynökségek hivatalos nézeteit.
Hozzászólások
Megjegyzés beküldésével vállalja, hogy betartja Általános Szerződési Feltételeinket és közösségi irányelveinket. Ha ezt sértő cselekedetnek találja, amely nem felel meg feltételeinknek vagy irányelveinknek, kérjük, jelölje meg nem megfelelőnek.
- Az irritábilis bél szindróma krónikus fájdalommal irritálja az életemet - tippek 2021
- Az anyagcsere 6 legjobb módja - 2021. tipp
- Teszt - a legjobb minden évszakra szánt gumiabroncs 2021 értékelés
- Állj meg és nézd, a rák véget ér velem - betegség 2021
- Széngrillezett teszt 2021 - a legjobbak rangsorolása