- elemeket
- absztrakt
- bevezetés
- az eredmény
- vita
- mód
- További részletek
- További információ
- PDF fájlok
- További információ
- Excel fájlok
- További táblázatok
- Hozzászólások
elemeket
- Evolúciós genetika
- A populációgenetika
absztrakt
Az embereknek több más amiláz génje van, mint más főemlősöknél. Az azonban még mindig nem teljesen világos, hogy mikor bővült a példányszám, és javult-e a terjesztése a kiválasztással. Itt értékeljük az amiláz kópiaszámát egy 480 nagy lefedettségű genom globális mintájában, és azt találjuk, hogy az amiláz lokuszt övező régiók a genetikai sokféleség jelentős csökkenését mutatják mind afrikai, mind afrikai populációkban. A genetikai variációk elemzése ezeken a területeken alátámasztja a korai szelektív seprés modelljét az emberi vonalon az emberek elválasztása után a neandervölgyiektől, ami az AMY1 több példányának rögzítéséhez vezetett egyetlen példány helyett. Az északkelet-szibériai régió alacsony keményítőtartalmú populációiban találtunk bizonyítékot az AMY2A törlés legmagasabb gyakoriságával (52%) az AMY2A törlés és az ezzel összefüggő alacsony AMY1 kópiaszám többszörös másodlagos elvesztésére.
Az alfa-amilázokat (a továbbiakban: amilázok) a nyálmirigyekben és a hasnyálmirigyben expresszálják az AMY géncsaládból származó gének, amelyek emberben változó számú gént tartalmaznak, amelyek keskeny klaszterként lokalizálódnak körülbelül 200 régióban. kb/kromoszóma referencia-egységenként: 1. Az AMY1 gén másolatai expresszálódnak a nyálmirigyekben, és lehetővé teszik a szénhidrátok egyszerű cukrokká bontását a lenyelés előtt. Az AMY2 másolatai a hasnyálmirigyben expresszálódnak, és ugyanezt a célt szolgálják a duodenumban is. Más majmokhoz képest az AMY lokusz jelentősen kibővült az emberekben, az 1., 2., 3., 4., 5., 6. populációban és azok között magas a kópiaszám-variáció (CNV). Számos tanulmány kimutatta, hogy az AMY1 gén nagyobb kópiaszámai az amiláz fokozott expresszióját okozzák a nyálban, ami valószínűleg lehetővé teszi a keményítőben gazdag ételek hatékonyabb emésztését 1, 7. Az amiláz CNV-re gyakorolt szélesebb körű fenotípusos hatását azonban továbbra is félreértik, mert az első jelentések az AMY1 kópiaszám testtömeg-index és az elhízás kockázatának összefüggéséről 7, 8 nem tudták megismételni 4 .
Az amiláz kópiaszám-amplifikáció az emberi evolúciótörténet kezdetén, a pleisztocén idején kezdődhetett meg. Mivel a nyálamiláz hatékonysága a főtt, nem pedig a nyers keményítők emésztésében jelentősen megnő 12, felmerült, hogy az amilázgének szaporodása energiaforrásként szelektíven előnyössé válna az agy növekvő méretének fenntartása érdekében, csak miután a főzés kibővült. Bár a homininek a tűz legkorábbi felhasználását a MYA 13, 9, 9-re jósolták, a kandallók következetes és ismételt használatának legkorábbi bizonyítékai újabbak és a középső pleisztocénben kezdenek megjelenni, csak kb. 300 KYA 14. A főtt ételek és a hominin agyméret közötti kapcsolat kiterjedt antropológiai kutatás tárgyát képezte 13, 15, 16, 17. Tekintettel az eddig rendelkezésre álló régészeti, antropológiai és genetikai bizonyítékokra, Hardy és mtsai. 9 feltételezte, hogy a főzőkeményítőben gazdag gumók elterjedése és elődeink több AMY1 kópia megszerzése kombinálva elősegítheti az agyméret gyors növekedését a korai középső pleisztocénban, körülbelül 800 KYA-t a modern emberek felosztása előtt. és a neandervölgyiek.
Az AMY-lokuszban és annak szélén felhalmozódott genetikai variációk mintái, amelyek a különböző emberi populációkban megtalálhatók, informatívak lehetnek e különböző lehetőségek kezelésére. Míg a korábbi 1., 3., 4. tanulmányok első információkat szolgáltattak a CNV globális elterjedéséről az AMY-ben, az adatokat még mindig eléggé lefedik olyan nagy régiók, mint Szibéria, Délkelet-Ázsia és Amerika. Ebben a tanulmányban 480 egyed nagy lefedettségű szekvencia adatait használjuk a világ minden tájáról származó mintákban, hogy az amiláz helyén a pozitív szelekció közelmúltbeli vagy régi jeleinek bizonyítékát keressük. Megerősítjük az AMY1, AMY2A és AMY2B gének kópiaszámának becslésének megbízhatóságát az olvasási mélység adataiból azáltal, hogy 68 minta részhalmazát genotipizáljuk paralóg arányú tesztekkel és mikroszatellit vizsgálati módszerekkel. A magas és alacsony AMY1 kópiaszámhoz kapcsolódó archaikus emberekhez kapcsolódó haplotípusok sokféleségének, életkorának és affinitásának felmérésével megvizsgáljuk, hogy a jelenlegi ősi kópiaszámhoz kapcsolódó haplotípusok magyarázhatók-e az ősök haplotípusának megtartásával, az archaikus hominokból történő behatolással hely.
az eredmény
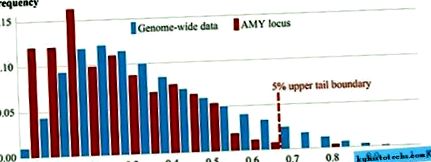
Hogy jobban megvilágítsuk azt a kérdést, hogy az AMY-lokusz nemrégiben pozitív emberi szelekció tárgyát képezte-e, először megvizsgáltuk az emberi populációk genetikai differenciálódásának mértékét az AMY-lokuszban más genetikai lokuszok kontextusában a globális magas lefedettségben 480 19. adatkészlet (S1. Táblázat). Összehasonlítottuk az SNY-k maximális Fst-értékeit az AMY-lokuszt közvetlenül körülvevő 200 kb-os régiókban a teljes genomadatokból kapott hasonló értékek eloszlásával, és megállapítottuk, hogy az amiláz-géneket kísérő genomi régiókat globálisan szignifikáns (χ 2 –Teszt, p 1, amely megjósolná az F st magas értékeit délkelet-ázsiai és északkelet-szibériai csoportjaink körében, és a megkérdezett populációk egyike sem mutatott jelet a közelmúltbeli pozitív szelekcióról a
Az "AMY hely" a Chr1 régió három összefüggő 200 kb-os szegmensére vonatkozik: 103 800 000 - 104 400 000. A 200 kb-os területek maximális ST ST-pontszámainak megoszlását a 0,05 kosár mutatja. Csak 5% szignifikáns (piros pontozott vonal) az AMY-lokuszra vonatkozó F ST-becslés Afrika és Északkelet-Szibéria összehasonlításából származik a Chr1 szegmensben: 104 000 000 - 104 200 000.
Teljes méretű kép
Asztal teljes méretben
Az y tengelyen a származtatott allél frekvencia összege az összes polimorf lókuszon az 1000 genom afrikai adataiban, az 1. kromoszóma nem átfedő szakaszainak 50 000 bp-ra becsülve, az emberi referenciaszekvencia eltérésétől ősszekvencia (6 főemlős konszenzusával határozta meg). A piros pontozott vonal az 1% -os küszöböt jelöli az empirikus eloszlás tekintetében a genomban. Csak azt az 50 000 bp-os szegmenst vették figyelembe, amely az emberi adatokban található helyek több mint 90% -át tartalmazta, Altaj-neandervölgyi és Denisovan-t.
Teljes méretű kép
Az elemzések az SNP-k bi-allélváltozataira korlátozódtak az LD-66 kb hosszú régióból (Chr1: 104, 303, 310-104, 369, 301), amely a (centromer) AMY1C géntől lefelé helyezkedik el (S1. Ábra). A koaleszcencia idő becsléseit az elágazási pontok közelében adjuk meg, és feltételezzük, hogy a mutáció mértéke 5,5 x 10 -10 per bp/év 34. BSP - Bayesi panoráma grafikon; a vastag barna vonal mutatja az effektív népességméret (N e) x generáció (y tengely) időbeli átlagértékét (x tengely)), a terület adatai alapján becsülve
66 kb kb. 480 egyedből álló globális mintában. A barna vonal körül színezett szürke terület a BSP-becslés hátsűrűségének 95% -os intervallumát mutatja 95% -kal. A pontozott kék nyíl kiemeli az emberi filogenitás egy ágát, amely valószínűleg a darab introgressziójának forrása volt.
16 kb (Chr1: 104, 350, 432-104, 366, 871) az altáji neandervölgyi genomba.
Teljes méretű kép
Asztal teljes méretben
Teljes méretű kép
Asztal teljes méretben
Asztal teljes méretben
vita
Összefoglalva: szokatlanul alacsony szekvencia-sokféleséget találunk az amiláz kópiaszám lókuszt meghatározó régiókban az emberi populációk globális populációjában. A markánsan negatív Tajima D-pontszám az afrikaiaknál, a modern és az archaikus emberek között rögzített különbségek jelenléte, valamint a modern emberi nemzetségben megjelenő fiatal koalesens dátum azt sugallja, hogy az amiláz lokusz szelektív beavatkozáson ment keresztül, miután az embereket elválasztották a neandervölgyiektől. Valószínű, hogy ez a szelektív szaporítás, amely az AMY1 gén több példányát rögzítette a modern emberi vonalakban, az étrendi eltolódásokkal és a keményítőben gazdag gumók feldolgozási szekvenciáinak feldolgozásával volt összefüggésben, ideértve például az őrlést, a kimosást és a főzést.
mód
Az AMY1, AMY2A és AMY2B gének másolatbeli származásával kapcsolatos haplotípusok életkorának becsléséhez 480 teljes genomiális szekvencia nagyfázisú lefedettségi adatait használtuk fel a Complete Genomics platform 19 segítségével. Először megvizsgáltuk a kötési egyensúlyhiány mintázatát a D 'statisztika segítségével (S1 ábra), a régióban
100 kb-ig felfelé és az AMY-helyszínen túl, hogy meghatározzuk a globális adatainkban a rendkívül magas kötési egyensúlyhiány régióinak határait. kit a haplotípusokon alapuló további elemzésekhez. A D 'statisztikát azokra a Bilelic SNP-kre számítottuk ki, amelyek MAF-értéke> 0,1 volt a globális mintánkban. Ezek az elemzések azonosítottak egy területet
66 kb (Chr1: 104, 303, 310-104, 369, 301) az AMY lokusztól lefelé, az SNP-k között magas átlagos (D '= 0,992) LD értékkel. Különösen az SNP a környéken
A 66 kb szintén viszonylag magas átlagos (D '= 0,839) LD-t mutat a 150 kb-os régió SNP-jével (Chr1: 104 000 001 - 104 150 000) az AMY kópiaszám változó helye előtt, ami erős összefüggést mutat nagy távolságokon. A BEAST 1.8 33 verziójával meghatároztuk a filogenetikai összefüggéseket és az eredeti haplotípusok életkorát a területen
66 kb. Minden életkor-számításhoz 5,5 x 10 x 10/bp/év 34 mutációs rátát alkalmaztunk felszabadult lognormális órákkal és lineáris Bayes-Skyline modellt 10 csoporttal. A fák nagy valószínűséggel RAxML - ből származnak. 7.8.6 35. Nyolc független BEAST-elemzést végeztek 100 millió iteráción, 5000 lépésenként mintavételezéssel. A Tracer v1.6 33-ban történő megtekintés után a független kísérletek eredményeit a LogCombiner v1.8.0 alkalmazásával egyesítettük 20% -os égési sérüléssel. Ezután Traceriben rekonstruálták a Bayes-Skyline-parcellákat, amelyek megerősítették, hogy az ESS-értékek 200 felett voltak.
Az AMY1, AMY2A és AMY2B gének kópiaszámának levezetéséhez a világminták 125 populációjából származó 480 egyed magas lefedettségi szekvencia adatait használtuk19. A Szibériából, Délkelet-Ázsiából és az Andokból származó 68 DNS-mintának egy alcsoportját tovább vizsgálták paralóg arányvizsgálattal és mikroszatellit-elemzéssel, hogy a másutt ismertetett módszerekkel meghatározzák a kópiaszám változását az AMY-lokuszon 3. Tájékozott beleegyezést kaptak minden itt tesztelt humán alanytól, és a DNS -ük genomikai munkáját az észak-orosz tudományos akadémia magadani biológiai problémáinak intézetének etikai bizottságai jóváhagyták (001. sz. Nyilatkozat)./011 (2011. január 21.) és az AMIS-UPS Etikai Kutatási Etikai Bizottsága, Toulouse-i Egyetem, Paul Sabatier (etikai jóváhagyási szám: 005/011). Minden genetikai elemzést és adatmanipulációt a Cambridge Ethics Research Ethics Commission (HBREC.2011.01) által jóváhagyott vonatkozó irányelveknek megfelelően hajtottak végre.
Az AMY1, AMY2A és AMY2B példányszámának az olvasási mélység adataiból történő meghatározásához a CG-ben megadott "relatív lefedettség" (R) metrikát használtuk. Mivel a referenciagenom az AMY1 gének három haploid kópiáját tartalmazza (AMY1A, AMY1B, AMY1C), az AMY1 diploid genomonkénti együttes példányszámát (R AMY1A/R AMY2B) × 6 alkalmazásával határoztuk meg. Ez a módszer Pearson r = 0, 92 korrelációs együttható az AMY1 paralóg arányteszten alapuló eredményekkel. Mind a 68 vizsgált minta két példányban tartalmazta az AMY2B-t az olvasási mélység és a paralóg arány arányai alapján. A CG kimenetből származtatott AMY2A példányszámok Pearson-féle korrelációs együtthatót mutattak r = 0,85 a teszt eredményeivel.
Annak a haplotípusnak a detektálása érdekében, amely ellen az AMY2A deléció történik (3. táblázat), meghatároztuk az AMY2A deléciók fázisát a Chr1 régióban található 891 bináris SNP szakaszos adatainak összefüggésében: 104, 303, 310-104, 369, 301 (hg19 ). Először megbecsültük az egyes szekvenált személyek esetében az AMY2A-deléció genotípusát úgy, hogy az AMY2A-példányszámból kivontuk a leolvasott AMY2B példányszámot az olvasási mélységből. Azonos vagy nagyobb AMY2A példányszámú mintákat homozigóta deléciós hordozóként, egyetlen különbséggel rendelkező heterozigótákként, és további két AMY2B másolattal rendelkező mintákat homozigótákként soroltuk be a törléshez. A Beagle 4.1 36-at heterozigóta minták fázisára és hiányzó AMY2A információkkal rendelkező minták utánzására használtuk .
További részletek
Hogyan lehet idézni ezt a cikket: Inchley, CE és mtsai. Az emberi amiláz gének szelektív söpörése a neandervölgyi hasítás után következik. Sci. ismétlés. 6., 37198; doi: 10, 1038/srep37198 (2016).
Kiadói megjegyzés: A Springer Nature továbbra is semleges a joghatósági igényekkel kapcsolatban a közzétett térképeken és intézményi szövetségekben.
- Alábecsülik a mesterséges megtermékenyítés gyógyszereinek kockázatát ”- Kulcsüzenetek
- Só az arany fölött Az óvodai ebédekben rengeteg van - Kezdőlap - Hírek
- Éves - jelentések - Rimaszombat és környéke - 7. oldal
- Gyors hírek a városból - Bölcsődék építése és a meglévő bölcsődék kapacitásának bővítése
- Az SMA szűrése segítene a tünetek nélküli gyermekek felderítésében - Kulcsüzenetek