absztrakt
A CÉL: Annak megvizsgálása, hogy az egyszeresen telítetlen (MUFA) zsírok szénhidrogén-cseréjét (CHO) követően az energia-mérleg körülményei között megfigyelt javulás a kardiovaszkuláris kockázati tényezőkben korlátozott energiájú körülmények között is megfigyelhető-e.
TERVEZÉS: Longitudinális klinikai beavatkozási vizsgálat kétféle korlátozott energiájú étrendet (a kezdeti energiafogyasztás −30% -a) hasonló telített és többszörösen telítetlen zsírtartalommal: magas CHO diéta (55% CHO energia, 10% MUFA) és magas MUFA diéta ( 40% energia CHO-ból, 25% MUFA-ból).
TÁRGYAK: Összesen 32 túlsúlyos beteg (kilenc férfi, 23 nő, BMI: 26-45 kg/m2).
MÉRÉS: A testtömeget, a szérum lipideket, az éhomi plazma inzulint és a vörösvérsejtek foszfolipid zsírsavösszetételét megmértük a kiinduláskor és 8 hét után. Ezen időpontokban különféle oxidatív állapot paramétereket (plazma lipid-hidroperoxidok, teljes plazma antioxidáns kapacitás, plazma húgysav és E-vitamin) és a szérum simaizomsejtek proliferációját (SMC) is mértük.
Tantárgyak és módszerek
elemeket
Összesen 52, 25 testtömeg-indexű (BMI, kg/m2)> 25 beteget vettek fel a montpellieri egyetemi kórház Metabolikus Betegségek Osztályának járóbeteg-osztályából, miután tájékozott beleegyezést kaptak. Egyik beteg sem szenvedett cukorbetegségben, vese- vagy májbetegségben, vagy olyan gyógyszereket szedett, amelyek befolyásolhatják a lipidanyagcserét. Összesen 18 beteget visszavontak (kilencet magas szénhidráttartalmú étrenden és kilencet magas MUFA-diétán), mert személyes vagy szakmai okokból nem tudták vagy nem akarták folytatni a protokollt az utolsó látogatásig. Kettőt kizártak a vizsgálatból, mert interkultív betegségük volt. Összesen 32 beteg (kilenc férfi és 23 nő) fejezte be az étrendi beavatkozási vizsgálatot. A tanulmányt az 1964-es helsinki nyilatkozatnak megfelelően végezték.
Dizájnt tanulni
Laboratóriumi elemzés
Az oxidációs állapotot a plazma lipid-hidroperoxidok, a teljes plazma antioxidáns kapacitás, valamint a lipid (E-vitamin) és az oldható plazma antioxidáns (húgysav) mérésével értékeltük. Az E-vitamint HPLC-vel mértük C18 reverz fázis és metanollal végzett izokratikus eluálással. A húgysavat urikáz módszerrel (Orthoclinical Diagnostic, Issy-les-Moulineaux, Franciaország) mértük. 19 A plazma lipid-hidroperoxidokat kolorimetriás módszerrel mértük, amely lehetővé teszi a lipid-hidroperoxidok szelektív mérését hidrogén-peroxid jelenlétében. Ez az eljárás, más néven FOX2, méri a vas-vas oxidációját vas-vasvá hidroperoxidokkal, a vas-vas mennyiségi meghatározásával xilenol-narancssárga színezékkel történő komplexképzéssel és az így kapott kromofor detektálásával 560 nm-en. A hidroperoxidok szelektív redukcióját szolgáló trifenil-foszfinnal kezelt plazmaminták és a kezeletlen plazma közötti különbség a hiteles lipid-hidroperoxidok mértéke, feltéve, hogy standard feltételeket tartanak be.
A plazma antioxidáns kapacitását a vas (FRAP) redukáló képességéből becsültük, ahol a Fe (III) -2,4,6-Tri (2-piridil) s-triazin (TPTZ) átalakulásából eredő intenzív kék szín kialakulása ) komplex Fe (II)) -TTPZ-vel közvetlenül összefügg a jelenlévő redukálószer mennyiségével. Nem húgysav értékek Az FRAP értékeket úgy számoltuk ki, hogy kivontuk a húgysav arányát (mért húgysav-koncentráció μmol/l × 2-ben) az összes antioxidáns kapacitásból.
Sima izomsejtek tenyésztése
Az SMC proliferációt az elemzésig -80 ° C-on tárolt szérumon mértük. Ugyanazon alanyokból származó mintákat (az intervenciós vizsgálat előtt és után) ugyanazon analitikai futtatásban teszteltük.
Aorta simaizom sejteket izoláltunk hím Wistar patkányokból a fent leírtak szerint. A sejteket DMEM/F-10-ben (Eurobio, Franciaország) inkubáltuk 10% magzati borjúszérummal, 2 mmol/l L-glutaminnal, 25 mmol/l HEPES-sel, 100 E/ml penicillinnel, 100 ug/ml sztreptomicinnel kiegészítve 37 ° C-on. C ° C nedvesített atmoszférában, 5% CO 2/95% levegőben. A sejteket simaizomként azonosították az aktív simaizom aktin jelenléte miatt. Összeolvadáskor a sejteket tripszin-EDTA-val leválasztottuk és szubkultúráztuk. Ebben a vizsgálatban három-hat átjárótól származó sejteket használtunk. A kísérletekhez a sejteket 24 üregű lemezekre oltottuk 40x103 sejt/lyuk koncentrációban. 24 óra elteltével a sejteket inzulint (1 μmol/l, Sigma), transzferrint (200 μg/ml, Sigma), aszkorbátot (0,2 mmol/l, Sigma) és nátrium-szelenitet (6,25 ng/ml). Sigma) 48 óra a szinkronizáláshoz a G0 szakaszban. A sejteket ezután a vizsgált alanyok szérumát (5%) tartalmazó táptalajban helyettesítettük. A média egyszer megváltozott. 5 nap elteltével a sejteket tripszin-EDTA-val gyűjtöttük, 4% -os formalinban rögzítettük és Coulter-számítógépen (Epics XL, Franciaország) megszámoltuk.
Statisztikai analízis
az eredmény
Az étrend betartása
A 2. táblázat mutatja a napi táplálékfelvételt minden étrendtípusra. Az ebben a táblázatban leírt mintaajánlatok egyike azon hét ajánlatnak, amelyek a 8 hetes beavatkozási időszak alatt 7,6 MJ/nap energiaszinttel váltakoztak. Kielégítő energiafelvételt regisztráltak, bár kissé alacsonyabb az előírtnál. Az ételbevitel (3. táblázat) azt mutatta, hogy az összes zsír, a CHO és a MUFA energiaszázaléka jelentősen különbözött (P 24 telített zsírsavak vagy a zsírszövetből a telített zsír differenciális felszabadulása a fogyás során).
Asztal teljes méretben
Asztal teljes méretben
Asztal teljes méretben
Fogyás
A testsúlycsökkenés -4,4 ± 0,6 kg volt a 4. héten és -6,7 ± 0,7 kg a 8. héten, átlagos kezdeti testsúlya 95 ± 3 kg volt. Nem volt statisztikailag szignifikáns különbség az étrendcsoportok között, függetlenül a kezdeti testsúlyhoz való igazítás utáni időponttól. Az egységnyi súlyveszteségre eső FM veszteség 0,70 volt, ami azt jelzi, hogy a súlyvesztés körülbelül 2/3-on ért el az FM, a fennmaradó 1/3-a pedig az izomtömeg, beleértve az izmokat és a vizet is. Ezt az arányt a diéta összetétele nem befolyásolta. A diétaidőszak végén jelentősen csökkent a derék kerülete (P 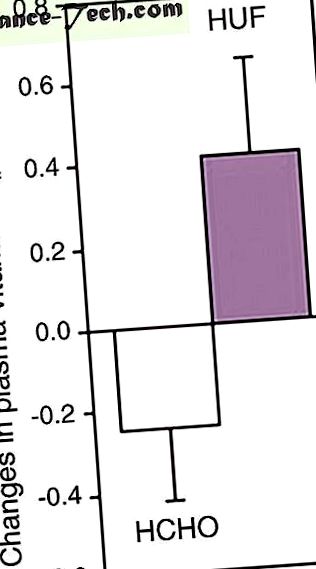
A normalizált E-vitamin átlagos (± sem) változása a plazmában 8 hét energia-korlátozás után (a kezdeti energiafogyasztás −30% -a) két különböző étrenddel: HCHO () magas szénhidráttartalmú étrend (n = 15); és HUF (
Teljes méretű kép
SMC elterjedése
A kiindulási ponthoz képest a proliferáció a HCHO diéta után szignifikánsan növekedett (+8,9 ± 4,5%, P = 0,024), de a HUF diéta után változatlan maradt (2. ábra). Az SMC proliferáció relatív változásai (%) negatívan korreláltak a HDL koleszterin változásával (r =, 0,37, P = 0,042). A regressziós modellben az SMC proliferációjának változásai negatívan társultak az olajsav és a linolsav arányának változásához, függetlenül a HDL-koleszterin változásától (7. táblázat).
A simaizomsejtek (SMC) proliferációjának átlagos (± sem) relatív változása (%) 8 hetes energiakorlátozás után (a kezdeti energiafogyasztás −30% -a) két különböző étrenddel: HCHO () magas szénhidráttartalmú étrend (n = 15); és HUF (
Teljes méretű kép
Asztal teljes méretben
vita
Ennek a vizsgálatnak a célja az étrendi MUFA-k súlycsökkenésre, a szérum lipidekre, az éhomi plazmakoncentrációkra, az antioxidáns státuszra és a szérum által kiváltott SMC proliferációra gyakorolt hatásának tisztázása volt túlsúlyos egyénekben az aktív testsúly rövid időtartama alatt (8 hét). rétegek.
Jelen eredmények azt mutatják, hogy az energiafogyasztás csökkenése ugyanolyan hatással volt a fogyásra, amikor a MUFA-kat CHO-zsírokkal helyettesítették, anélkül, hogy megváltoztatták volna az SFA és a PUFA koncentrációját. Rövid távú testsúlycsökkentési kísérletek során beszámoltak arról is, hogy a csökkent tápanyagtartalmú étrendekre gyakorolt makrotápanyag-tartalom nem befolyásolja a fogyást. 26, 27, 28, 29, 30
A fogyás és az étkezési zsírösszetétel befolyásolhatja az SMC-k szaporodását, ami fontos esemény az érelmeszesedés kialakulásában. Mata és mtsai 36 kimutatták, hogy a MUFA-val dúsított étrend csökkentette a DNS-szintézist az SMC-ben, de nem mérte a sejtek proliferációját. Eredményeink első alkalommal egyértelműen megmutatták, hogy a szérum által kiváltott sejtproliferáció súlycsökkenésre adott válasza az étrend összetételétől függ: MUFA-val dúsított étrend megakadályozta a proliferáció növekedését, ahogyan azt a HCHO diéta megfigyelte. Ezenkívül az SMC proliferációjának változásai negatívan társultak az olajsav és a linolsav arányának változásához, függetlenül a HDL-koleszterin változásától. A HCHO diéta fokozott szaporodása azonban váratlan volt. A lipid- és glükóz-anyagcsere javításának csökkentenie kell a proliferációra való hajlamot, mivel az atherosclerosisban az oxidált LDL antagonistája, a HDL nem csökkent a diéta után ebben a csoportban. Javasoljuk, hogy az olajsavszint vagy az olajsav és a linolsav arányának változásai, amint azt az eritrocita membrán foszfolipidjeinél megfigyelték, valószínűleg bekövetkeznek a plazma lipoproteinekben, és erős szabályozó hatással lehetnek az SMC proliferációjára.
Összegzésképpen megmutattuk, hogy ezen a 8 hetes súlycsökkentési kísérlet során az MUFA vagy CHO útján történő energiafogyasztás 30% -os csökkentése ugyanolyan hatást gyakorolt a fogyásra, a szérum koleszterinszintre és az éhomi inzulinra. Azonban ezekben az energiakorlátozási körülmények között is a MUFA-ban gazdag étrendnek jobb hatása volt a szérum TG-koncentrációjára, mint a CHO-ban gazdag étrendre, ami arra utal, hogy a MUFA-ban gazdag étrendnek hosszú távon kardiovaszkuláris előnyei lehetnek. Ezenkívül a plazma E-vitamin-koncentrációjának és a szérum által kiváltott SMC-proliferáció változásai összhangban voltak az olajsav oxidatív állapotra és az SMC-proliferációra, azaz a kardiovaszkuláris kockázatra gyakorolt védő hatásával. Így a testsúlycsökkenés és a telített zsírok 10% -os százalékos csökkentése - amint azt ebben a tanulmányban elértük - megengedi a CHO és MUFA közötti eloszlás modulálását a beteg preferenciái, az anyagcsere profilja és a táplálkozási célok szerint, de a MUFA bevitel.
- Szeretem a repceolajat! Zsírok a nők és férfiak étrendjében
- Szeretem a repceolajat! Zsírok a pajzsmirigybetegségekben és a cukorbetegségben szenvedők étrendjében
- Cink - hatások, cinkhiány, adagolás
- Minden, ami az erősítést, az étrendet, az edzésterveket illeti
- Ricinusolaj mint hajmentő. Milyen hatásai vannak?
