elemeket
absztrakt
A de novo AML-ben szenvedő gyermekek 5-10% -ánál és a relapszusos AML-ben szenvedő betegek 23% -ánál refrakter betegség definiálható úgy, hogy két kemoterápiás ciklus után nem sikerült elérni a morfológiai remissziót. 1, 2, 3, 4 Mivel az AML előfordulása a gyermekpopulációban az Egyesült Királyságban évente 70 eset, 8–12 gyermek várhatóan refrakter AML az országban. Történelmileg ennek a betegcsoportnak a prognózisa semleges volt, a közelmúltban végzett kooperatív vizsgálatok szerint az elsődleges refrakter és refrakter gyermek AML teljes túlélése (OS) 22 és 14% volt. 3, 4
Ezeknek a betegeknek a legjobb kezelését még nem sikerült meghatározni. Az allogén hematopoietikus őssejt-transzplantáció (SCT) a magas kockázatú frontális vagy relapszusos AML ellátásának szokásos standardja. 5., 6., 7. A refrakter betegség miatt SCT-n átesett betegek kimenetelére vonatkozó adatok azonban torzak. Különböző megközelítések és következetlen kohorszok nagyon eltérő eredményeket hoztak, a túlélési arány 0-35%, a transzplantációval összefüggő mortalitás (TRM) pedig akár 40%. 4, 9, 8, 9, 10, 11, 12, 13, 14
Különösen azoknál a gyermekeknél, akiknél a transzplantáció során nincs remisszió, négy különböző dokumentumban összesen 160 beteget jelentettek. 4, 8, 10, 14 E dokumentumok közül három (köztük két leendő országos tanulmány) 0% -os hosszú távú OS-t dokumentál az SCT-ben aktív betegségben szenvedő gyermekek számára. 4, 10, 14 Ezzel szemben Bunin és mtsai. 8 dokumentált leukémiamentes túlélés (LFS): 12% az elsődleges refrakter AML-ben szenvedő gyermekeknél és 20% a relapszusban szenvedő refrakter betegeknél. Ezen túlmenően az OS 19% -áról számoltak be a transzplantáció során remisszióban lévő AML-ben szenvedő 1428 beteg felnőtt és gyermek CIBMTR-adatait ötvöző regisztrációs elemzésben. Ebben az összefüggésben a transzplantációban előforduló blasztok százalékos arányát, a nem megfelelő vagy nem kapcsolódó donort, a gyenge teljesítményállapotot és az alacsony kockázatú citogenetikát javasolták a rosszabb eredmény lehetséges kombinált rizikófaktoraként.
A refrakter AML kedvezőtlen prognózisa miatt egy nemrégiben készült áttekintés visszatartja az SCT ellátását olyan felnőttek számára, akiknél a transzplantáció során a csontvelőben (BM) a blasztok százaléka meghaladja a 25% -ot. A hasonló helyzetben lévő gyermekek kezelésére vonatkozó ajánlások nem állnak rendelkezésre. E betegek többségéhez nincs szükség más alternatív kezelési lehetőségre, ezért további adatokra van szükség a tájékozott és a betegre szabott döntés meghozatalához. Ez a multicentrikus, retrospektív vizsgálat célja az eredmények kiértékelése és a prediktív tényezők azonosítása volt azoknál a gyermekeknél, akik az első SCT-t kapták primer refrakter vagy visszatérő refrakter AML-ben, aktív betegséggel az SCT-ben.
Anyagok és metódusok
betegek
0-18 éves betegek, akiknél az Egyesült Királyság 13 gyermekgyógyászati transzplantációs központjában 2000 és 2012 között az első allogén SCT-n átesett primer refrakter vagy relapszáló refrakter AML, és beszámoltak a brit vér- és csontvelő-transzplantációs társaságnak ( BSBMT). erre a vizsgálatra, ha a kondicionáló kezelés megkezdésétől számított 2 héten belül dokumentálták aktív betegségüket. Az AML FAB M3 és a fiatalkori mielomonocita leukémiában szenvedő betegeket kizárták a vizsgálatból. A refrakter betegséget úgy definiálták, mint morfológiailag, vagy citogenetikai vagy molekuláris módszerekkel, vagy bizonyított extramedulláris (EM) betegségben a BM-ben bekövetkezett> 5% blaszt.
2 ciklus indukciós/reindukciós kemoterápia.
Az elsődleges indukciós kudarcot> 5% blasztként határozták meg a BM-ben morfológiailag vagy citogenetikával, vagy molekuláris módszerekkel a második indukciós tanfolyam végén.
A CR-t a BM normális vérképzéssel és morfológiailag 6, 16 határozta meg
A forrásadatokat a morfológia és a citogenetikai/molekuláris eredmények jelentős időponttal történő vizsgálatával igazolták a refrakter betegség diagnózisának megerősítéséhez minden betegnél, de az SCT előtt nem végeztek centralizált morfológiai áttekintést a csontvelő-aspirátumból.
Hozzájárulás a BSBMT nyilvántartásba az eredmények elemzéséhez és a kutatáshoz a transzplantáció idején, az EBMT iránymutatásainak megfelelően került bejegyzésre.
Átültetés
A HLA-kompatibilitást egy felnőtt vagy rokon donorral HLA-A, -B, -C, -DR, -DQ lokuszok magas/közepes felbontású tipizálásával határoztuk meg. A HLA kompatibilitást a független vezetékkel a HLA-A, -B, -DR lokuszok nagy/közepes felbontású tipizálásaként határoztuk meg. A testvér donorral való HLA kompatibilitást a HLA-A, -B, -C, -DR, -DQ alacsony felbontású tipizálásával határoztuk meg. A donorokat HLA azonos testvérekként határozták meg, ha ugyanazokat a szülői haplotípusokat örökölték, mint a befogadók. A donor-recipiens párokat HLA egyezésnek (MD) határoztuk meg, ha egyébként 10/10 (felnőtt donor) vagy 6/6 (kábel) és HLA eltérés (MMD).
A kondicionálási sémákat "csökkent intenzitásként" határoztuk meg a Champlin-kritériumok szerint és mieloablatív módon. Röviden: a kondicionáló kezelést akkor tekintettük mieloablatívnak, ha irreverzibilis citopeniát okozott őssejtmentés nélkül és csökkent intenzitással, ami reverzibilis myelosuppresszióhoz vezetett, amely alacsony szintű nem hematológiai toxicitással társult. 17.
Tanulmányi végpontok
A vizsgálat elsődleges végpontja LFS volt 5 évvel az SCT után remisszióban átültetett primer refrakter vagy visszatérő refrakter AML-ben szenvedő gyermekeknél. Az LFS-t a transzplantációtól a visszaesésig vagy bármely okból bekövetkező halálig eltelt időnek tekintették, attól függően, hogy melyik következik be először. A másodlagos végpontok között szerepelt az akut és krónikus GVHD előfordulása, a relapszusok aránya, a TRM és az 5 éves OS. A TRM a Cseh Köztársaságban bekövetkezett bármely haláleset; Az OS-t az SCT-től a halálig tartó időnek határozták meg, az okuktól függetlenül.
Statisztikai analízis
A betegadatokat a BSBMT adatbázisán keresztül gyűjtötték össze, és minden egyes központnál igazolták. Az adatok konzisztenciáját ellenőriztük, és a végső elemzést a Stata statisztikai szoftver (StataCorp. 2015. Stata Statistical Software: Release 14, College Station, TX: StataCorp LP) és R. segítségével végeztük el. A későbbi frissítést 2016. január 1-jén frissítettük. Leíró elemzések eredményei mediánként és tartományként adják meg. Az LFS és az OS becsléséhez Kaplan-Meier becsléseket és konfidencia intervallumokat, összehasonlításhoz log rang tesztet (diszkrét változók) és Cox regressziót használtunk. 18 A betegeket az utolsó követéskor cenzúrázták, ha nem történt esemény. Becsülték a relapszus és a TRM kumulatív előfordulását, ami lehetővé teszi a verseny-kockázatokat a Fine-Gray módszer alkalmazásával. 19 A Cox-kockázat Prox-arányos regressziós modelljeit használtuk a következő változók relapszus életkorra, LFS-re és OS-re gyakorolt hatásának értékelésére: életkor, citogenetikai kockázati csoport, primer versus visszatérő refrakter, blasztok százaléka a BM-ben SCT-ben, kondicionáló kezelés, donor típus (használat versus eltérés).), a T-sejtek kimerülése, az őssejtek forrása, valamint az akut és krónikus GVHD jelenléte. A konfidencia intervallumokat 95% -nál jelentik, a statisztikai vizsgálatokat pedig 0,05 (kétoldalú).
az eredmény
A betegek jellemzői
A BSBMT nyilvántartásból hatvanegy beteget azonosítottak refrakter AML-ben részesülőként SCT-kben, nem Csehországban az SCT-kben 2000 és 2012 között. Két beteget kizártak a fiatalkori mielomonocita leukémia diagnózisa alapján, és 15 beteget kizártak az adatok validálásaként. nem erősíti meg a refrakter AML diagnózisát. A fennmaradó 44 beteget elemezték, akiknél a forrásadatok igazolása refrakter betegséget igazolt. A vizsgálatba bekerült 44 beteg jellemzőit az 1. táblázat foglalja össze.
Asztal teljes méretben
A transzplantáció jellemzői
Asztal teljes méretben
Transzplantációs folyamat
A 3. táblázat összefoglalja kohorszunk transzplantáció utáni eredményeit. Egy beteg meghalt a +10. Napon (szeptikus esemény) és egy napon a +14. Napon (a betegség progressziója). A 42 értékelhető beteg közül 39-en értek el adherenciát (93%). A neutrofil beültetésig eltelt medián idő 15 nap volt (10-42 tartomány). Két betegnél a graft megismétlődött (5%). Az akut GvHD-t 23 betegnél (52%) jelentették, nyolc betegnél (19%) súlyos volt. Egy betegnél korlátozott és két kiterjedt krónikus GvHD volt, az összes előfordulás 7% volt. A csoportunkban két betegnél a GvHD-t tekintették a halál okának.
Asztal teljes méretben
az eredmény
Kilenc beteg halt meg Csehországban a transzplantációval összefüggő okok miatt (kettő GVHD-vel kapcsolatos, egy kardiális toxicitás, egy mellkasi Aspergillus-fertőzés, egy encephalitis, egy CMV-vel kapcsolatos fertőzés, egy szepszis, egy endocarditis, egy adenovírussal kapcsolatos tüdőgyulladás). A nyolc beteg közül öt meghalt az SCT után +100. Nap előtt. A TRM a +100 és a +365 napon 11% (95% CI 4-23%) és 18% (95% CI 9-31%) volt.
A 44 beteg közül 30 (68%) érte el a CR-t SCT után. Tizennyolc ember él a Cseh Köztársaságban, és 5 éves LFS ebben a csoportban 43% (95% CI 28–57%) volt, a medián követés 6 év és 9 hónap volt. Tizenhét beteg visszaesett átlagosan SCT után 61 nappal (13–279 tartomány), és mindegyikük a betegség progressziójában halt meg. Az egyik beteg, aki visszaesett, a későbbi kezelés után egy második SCT-n átesett, és a betegség progressziója miatt visszaesett és meghalt. A relapszus kumulatív incidenciája 5 év után 32% volt (95% CI 19–46%).
Alcsoportelemzés
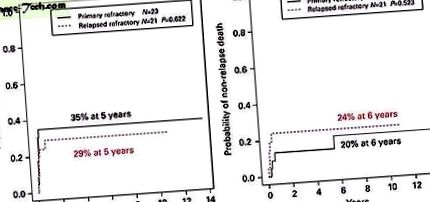
A kiújulás és a nem relapszusos mortalitás kockázata hasonló volt primer refrakter és recidív refrakter betegségben szenvedő betegeknél (1. ábra). Ennek eredményeként az 5 éves LFS és OS primer refrakter AML-ben szenvedő betegeknél (43% (CI 22-62%) és 43% (CI 22-62%)) átfedésben voltak relapszusban szenvedő refrakter betegségben szenvedő betegekkel (43% (CI 22) -62%)). –62%) és 43% (CI 22–62%)) (2. ábra). Hasonlóképpen, a káros citogenetikájú betegek teljesítménye nem volt rosszabb, mint a szokásos citogenetikájú betegeknél (kumulatív relapszus arány 29% vs. 42%, P = 0,345). Ezzel szemben a kedvező citogenetikai profillal rendelkező betegek egyike sem ült vissza a transzplantáció után (3. ábra), és 5 éves LFS-jük 67% volt (CI 19–90%), bár ez az alacsony betegszám miatt nem ért el statisztikai szignifikanciát ebben az esetben. (n = 6).
a ) SCT után a relapszus kumulatív előfordulása primer refrakter AML-ben szenvedő gyermekeknél és relapszusú refrakter AML-ben szenvedő gyermekeknél. ( b ) A nem relapszusos halálozás kumulatív előfordulása SCT után primer refrakter AML-ben szenvedő gyermekeknél és relapszusú refrakter AML-ben szenvedő gyermekeknél. Ennek a képnek a színes változata elérhető az online transzplantációs csontvelő transzplantációban.
Teljes méretű kép
a ) Leukémia nélküli túlélés SCT után primer refrakter AML-ben szenvedő gyermekeknél és relapszusú refrakter AML-ben szenvedő gyermekeknél. ( b ) Teljes túlélés SCT után primer refrakter AML-ben szenvedő gyermekeknél és relapszusú refrakter AML-ben szenvedő gyermekeknél. A kép teljes színes változata elérhető az online transzplantációs csontvelő transzplantációban.
Teljes méretű kép
A relapszus kumulatív előfordulása SCT után refrakter AML-ben szenvedő gyermekeknél a diagnózis során a citogenetikai kockázati csoport szerint. Citogenetikai kockázati csoportok Swerdlow és munkatársai szerint. 16 és Creutzig és mtsai. 6 A kép teljes színes változata elérhető a Transzplantációs csontvelő transzplantáció online oldalon.
Teljes méretű kép
A 4. táblázat összefoglalja az LFS elemzett prognosztikai tényezőit, a relapszusok előfordulását és a halálozás megismétlődésének arányát csoportunkban. A regressziós elemzés azt mutatta, hogy a BM-ben 30% -nál magasabb blasztok százalékos arányú transzplantációja szignifikánsan magasabb relapszus-kockázatot jelzett (60% vs. 15%, P = 0,004), míg a mieloablatív bevitel és az akut GVHD kialakulása pozitívan befolyásolta az eredményt betegcsoport (4a. ábra). A transzplantációval kapcsolatos egyéb jellemzők (donor, őssejt-forrás, T-sejt-kimerülés) nem befolyásolták a hosszú távú eredményt. A ~ 10 éves betegek a transzplantációval összefüggő mortalitás növekedését mutatták (5% vs. 29%, P = 0,05).
Asztal teljes méretben
a ) Leukémia-mentes túlélés myeloablatív stabilizációt (MAC) kapó és akut GVHD-ban szenvedő gyermekeknél azokhoz a gyermekekhez képest, akiknél nem alakul ki akut GVHD, és akiknek csökkent kondicionálási intenzitása (RIC). b ) Leukémia-mentes túlélés 10 éves gyermekeknél, akik SCT-n estek át, a csontvelőben több mint 30% -os blasztot kaptak, összehasonlítva a csoport összes többi betegével. A kép teljes színes változata elérhető az online transzplantációs csontvelő transzplantációban.
Teljes méretű kép
A fenti kockázati tényezők összevonásával sikerült azonosítani egy olyan gyermekcsoportot, amelynek nagyon nagy a visszaesés kockázata. A 10 éves betegek, akiknél SCT-ben> 30% a blaszt, szignifikánsan rosszabbul teljesítettek, mint populációnk többi része, ami szinte kimutathatatlannak bizonyult (LFS 10% vs. 53%, P = 0,037, 4b. Ábra).
vita
Bár az SCT-t gyakran használják a magas kockázatú AML kezelésére, szerepe a kemoterápiás betegség összefüggésében még mindig vitatott. Ez a tanulmány megvizsgálta az SCT szerepét a refrakter AML és prognosztikai jellemzőkkel rendelkező gyermekgyógyászati betegeknél ebben a tekintetben. Sorozatunk azt mutatja, hogy az SCT jelentős számú aktív AML-beültetett gyermeknél kezelhető, 5 éves VZPS-sel, 43% -kal. Különösen kimutattuk, hogy az SCT-ben alacsony betegségterhelésű fiatalabb betegek figyelemre méltó, 53% -os LFS-t értek el. Vizsgálatunk egyik fő korlátja, hogy a nyilvántartás jellege kizárja annak értékelését, hogy hány refrakter AML-t diagnosztizáltak a vizsgálati időszak alatt az Egyesült Királyságban, kihagyva a fontos információkat arról, hogy hány beteget tekintettek alkalmatlannak az SCT-hez vagy meghaltak kezelés alatt. várakozás az SCT-re (becslésünk szerint körülbelül 120 refrakter AML-ben szenvedő beteget diagnosztizáltak az Egyesült Királyságban a vizsgálati időszak alatt). Ez viszont jelentős szelekciós tendenciát eredményez a betegcsoportunkban.
Ezenkívül csoportunk 18 betegnél refrakter betegséget diagnosztizáltak SCT-n a BM morfológiai értékelése alapján, molekuláris vagy citogenetikai megerősítés nélkül. Míg a morfológiai értékelés magában foglal bizonyos fokú szubjektivitást, ebben a vizsgálatban a relapszus előfordulása a kizárólag morfológia alapján refrakter kezeléssel diagnosztizált betegek között statisztikailag nem különbözött a molekuláris/citogenetikai megerősítést igénylő betegek incidenciájától (a relapszusok előfordulása 53% vs. 30 %). P = 0, 1, CI 0, 8 - 6, 5).
A retrospektív nyilvántartási vizsgálat korlátain belül adataink azt mutatják, hogy az aktív refrakter AML-ben szenvedő gyermekek jelentős része kezelhető SCT-vel, különösen a kedvező citogenetikájú gyermekek, a 10 évesnél fiatalabb betegek és a BM-ben a blasztok kevesebb mint 30% -a gyermekeknél. SCT. Ez a tanulmány azt is sugallja, hogy a mieloablatív kondicionáló kezelés, valamint a GVL javítására irányuló stratégiák előnyösek lehetnek ebben az összefüggésben. Adataink szerint a transzplantáció nem tűnik jelentős esélynek a 10 évesnél idősebb betegek gyógyítására, és a BM-ben 30% -nál nagyobb mértékben robbannak. Ezért ezt a gyermekcsoportot gondosan értékelni kell az 1. fázis/új kezelés vagy a palliatív ellátás tanulmányai alapján, klinikai állapotuk és családi hajlamuk szerint.
- Allogén hematopoietikus sejttranszplantációk t-sejt-kimerüléssel, mint az örökbefogadás platformja
- Hogyan válasszuk ki a minőségi WomanMan sertéshúst
- Hogyan lehet megtanulni fogni a kezét egy 22 hónapos kék ló babának
- Agatha Christie gyilkosság az Orient Expresszben - szlovák író
- 5 értékelés Magazin