- elemeket
- absztrakt
- bevezetés
- Korhoz kötött makula degeneráció
- Β - kiterjesztés, szerkezet és dinamikus összeállítás
- Az Aβ hatásmechanizmusa degeneratív idegsejtekben
- Az Aβ bizonyítéka az öregedő retinában és az AMD-ben
- Konstitutív Aβ képződése a normál retinában
- A retina retinális nyílása az életkor előrehaladtával növekszik
- Összesítés o részt vesz az AMD kulcsfontosságú szakaszaiban
- P- a retina lerakódásai gyulladásgátló és proangiogén mikrokörnyezeteket váltanak ki
- Az AMD kockázati tényezői elősegítik az A-t β aggregáció az öregedő retinában
- AMD és anti-Aβ antitest kezelés állatmodelljei
- Β és AMD - a neurodegeneráció és a további cselekvések tanulságai
elemeket
absztrakt
Az életkorral összefüggő makula degeneráció (AMD) a retina kritikus területét érintő, makula néven ismert komplex szemészeti rendellenesség, amely kritikus a központi látás és a finom részletek érzékeléséhez. A betegség az irreverzibilis vakság elsődleges oka azokban a társadalmakban, amelyek demográfiai adatai az életkor előrehaladásának kedveznek. Ennek a degeneratív rendellenességnek az etiológiája kevéssé ismert, de magában foglalja mind a genetikai, mind a környezeti kockázati tényezőket. 1, 2, 3 A degeneratív patológiában központi szerepet játszik a fotoreceptor atrófiával és az alatta lévő retina pigment epitheliummal (RPE) összefüggő vizuális funkciók elvesztése, amely a vér-retina gátat képezi. A közelmúltban 4, 5 retina ganglion sejtet (RGC) és az RPE monoréteget azonosítottak az amiloid béta (Aβ) szintézis és szekréció fő forrásaként a hátsó szemben. 6 Az Aβ egy nagyon behatoló és erősen toxikus fehérje, amely agresszíven célozza meg az idegsejteket, és a neurodegeneratív betegségek egyik fő jellemzője. 7, 8 Újabb Aβ tartályokat fedeztek fel a szemben a retina környezetében, míg az emelkedő Aβ szinteket az öregedő retinában találták, és az AMD progressziójának kulcsfontosságú szakaszaihoz kapcsolódtak. 6 Ezek a megállapítások alátámasztják azt a hipotézist, miszerint az Aβ kulcsfontosságú, bár korábban jellemezhetetlen szerepet játszik az öregedő makula degeneratív folyamatainak hajtásában.
Itt gyűjtjük az AMD-t, a neurodegenerációt, valamint a β-strukturális biológiát vizsgáló szakirodalom legfrissebb ismereteit, amelyek alátámasztják hipotézisünket, és betekintést nyújtanak az alapvető degeneratív eseményekbe, amelyek ronthatják az öregedő retinát. Annak jobb megértése, hogy az Aβ miként tudja megcélozni a retina működését, segíthet új terápiák tervezésében az AMD kezelésére a jövőben.
Korhoz kötött makula degeneráció
Az AMD a visszafordíthatatlan vakság leggyakoribb oka az idősödő társadalmakban, és globálisan érinti
50 millió közvetlen költséggel rendelkező személy közel 255 milliárd dollárra becsülhető. 9 A betegség befolyásolja
Bár az AMD-t klinikailag jellemezték, a mögöttes mechanizmusok, különösen a korai betegség idején, továbbra sem teljes mértékben ismertek. A száraz és nedves AMD közötti molekuláris jellemzés hiánya ezért a betegség megértését és meghatározását elsősorban klinikai megfigyelésekre és terminológiára korlátozta. Az Aβ legutóbbi felfedezése az öregedő retinában és az AMD-vel való társulása izgalmas lehetőséget jelent arra, hogy az AMD-t új szempontból szemléljék, és új molekuláris kifejezésekkel jobban megértsék a betegség kialakulását és progresszióját.
Β - kiterjesztés, felépítés és dinamikus összeállítás
A 21q21 kromoszómán elhelyezkedő amiloid prekurzor fehérje (APP) gén az alternatív módon expresszált I típusú integrált membrán glikoproteint kódolja számos alternatív összekapcsolási formában, amelyek leggyakoribb izoformái az APP 751, az APP 770 és az APP 695. A jelentések szerint az APP-transzkriptumok és fehérjék bőségesen expresszálódtak egér, patkány, valamint humán RGC és RPE sejtekben (14, 15), az APP 695 az agyban expresszált fő izoform. 16 Az APP funkciója (i) továbbra is érthetetlenek, a legtöbb tanulmány arra utal, hogy az agy több útján keresztül jelez. 17 Az APP proteolitikus feldolgozása két egymást kizáró útvonalon megy végbe, amiloidogén és nem amiloidogén (vagy konstitutív) útnak nevezik őket. 18, 19 Az APP fokozatos hasítása az amiloidogén úton β- és γ-szekretáz enzimekkel monomer Aβ peptidet eredményez, amelynek molekulatömege
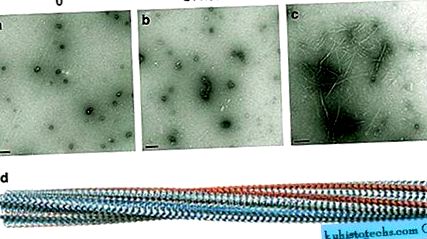
(a - c) Tekintse meg a negatívan festett elektronmikroszkópos felvételeket, amelyek az Aβ 1-42 önfelépülését mutatják 7, 4, 50 μM pH mellett. (a) Kis gömb alakú oligomereket mutat, amelyek azonnal láthatók az Aβ 1-42 peptid elkészítése után. (Soura és mtsai. 50). Ezeket 24 órán belül tovább összeszereljük, hogy 48 órás inkubálás után b) hosszúkás protofibrillákat és végül c) amiloidfibrillákat képezzünk. d Az amiloid szál szerkezeti modelljét mutatja, amely a ß szerkezetből áll, és lassan csavart architektúrát mutat. A modellgenerálást Morris et al. 101
Teljes méretű kép
Az Aβ hatásmechanizmusa degeneratív idegsejtekben
Az Aβ bizonyítéka az öregedő retinában és az AMD-ben
Konstitutív Aβ képződése a normál retinában
Mind a retina, mind a központi idegrendszer (CNS) közös eredetű, mivel mindkettő a kialakuló idegcsőből származik. Mindkét szerkezet szorosan összefügg a szomszédos érrendszerrel a vér-retina és a vér-agy gátakon. Az életkor előrehaladtával mind a retina, mind az agy extracelluláris lerakódások alakulnak ki a degeneratív patológiával kapcsolatban, amelyeket drusen és szenilis plakkoknak neveznek. Ezért nem meglepő, hogy a drusen és a szenilis plakkok között sok feltűnő hasonlóság tartalmazza az Aβ-t. Egyéb megosztott összetevők a következők: a szérum amiloid P, az apolipoprotein E, az immunglobulin, az alapmembrán mátrixok, a proteoglikánok és a fémionok (Fe 3+, Cu 2+ és Zn 2+) komponensei, az akut fázisú reagensek, a proteázzal/clearance-sel kapcsolatos elemek és számos komplementer fehérje mint egyéb gyulladásos mediátorok, amelyek tipikusan a retina lerakódásaival társulnak helyi gyulladásra. A drusen és a szenilis plakkok ilyen figyelemre méltó hasonlóságai, amelyek összhangban állnak az életkorral és a rossz klinikai prognózissal, arra utalnak, hogy a hasonló kóros mechanizmusok degeneratív változásokhoz vezethetnek mind a retinában, mind az agyban.
A retina retinális nyílása az életkor előrehaladtával növekszik
Az életkor előrehaladtával az Ss lerakódása nem korlátozódott az RPE alatti területekre, hanem váratlanul kiderült, hogy idősebb egerekben felhalmozódik a fotoreceptor (POS) külső szegmenseiben. Az ilyen lerakódásokat csak 3 hónap múlva azonosították, és a 12. hónapban a külső szegmenseket teljesen Aβ-tartalmú anyagba tekerték, ami 24 hónapon belül minőségileg eltérőnek tűnt. 60 Bár nincs közvetlen bizonyíték arra, hogy az ilyen anyag pusztán Ap β, az immunfestő Aβ minták és az EM képek szkennelése közötti szoros kapcsolat azt állítja, hogy Ap legalább az ilyen korhoz kapcsolódó lerakódások eleme. Ezenkívül az oligomer Aβ40 intravitreális injektálása vad típusú patkányokhoz a legmagasabb immunfestési intenzitást eredményezte a POS-ban, támogatva az Aβ preferenciális felhalmozódásának gondolatát az RPE sejtek apikális közelségében. A 31 és 90 év közötti humán poszt-mortem minták elemzése a POS-ban növekvő Aβ immunfestés hasonló mintáját tükrözte. Az Aβ felhalmozódásának ez a modellje, amely a POS csúcscsúcsától indul és hosszában folytatódik, szemlélteti az Aβ, 60 specifikus aggregációját, és mint ilyen, összhangban áll más 14, 54., 55., 56. megállapításokkal, amelyek az Aβ retina/RPE felhalmozódását mutatják. . az életkor előrehaladtával a hátsó szemben (2. ábra).
Az Aβ szintézisének, szekréciójának és aggregációjának több helyét bemutató séma az öregedő retinában (vörös csillag), amelyről az irodalomban beszámoltak. BrM, Bruch membránja; POS, a fotoreceptor külső szegmensei; RGC, retina ganglion sejtek; RPE, retina pigment hám.
Teljes méretű kép
Az p összesítés részt vesz az AMD kulcsfontosságú szakaszaiban
Az Aβ csoportok túlsúlyban vannak azoknál az egyéneknél, akiknél közepesen magas a drusen szint. Az Aβ az amiloid vezikuláknak nevezett gömbstruktúrákba rendeződik, amelyek elfoglalhatják a drusen térfogatának nagy részét, és potenciális helyeket hozhatnak létre a komplement aktiválásához. A drusen lehet sűrűn több amiloid vezikulában, vagy csak egy nagy vezikulumot tartalmazhat. A különböző Aβ struktúrák jelenléte tükrözheti a betegség előrehaladásával járó drónok fejlődő természetét. Például több oligomer mag jelenléte egy nagy drusenban annak lehet köszönhető, hogy a drunok idővel kevesebb agglomerálódnak. Az ap in drusen korrelál a degenerálódó fotoreceptorokkal és az RPE-vel. CC, choriocapillaris; BrM, Bruch membránja; RPE, retina pigment hám.
Teljes méretű kép
A retinában lévő P-lerakódások gyulladásgátló és proangiogén mikrokörnyezeteket váltanak ki
Az AMD kockázati tényezők elősegítik az β aggregációt az öregedő retinában
AMD és anti-Aβ antitest kezelés állatmodelljei
Az életkorral összefüggő, összetett etiológiájú degeneratív betegségként az AMD patológiájának teljes spektrumának reprodukciója állatmodellekben. Ez azonban nem akadályozta meg számos rágcsáló, nyúl, sertés és főemlős állatmodelljének kialakulását. A széles körben alkalmazott egér/patkány modellek előnye az alacsonyabb költségek, az egyszerű karbantartás és a betegség tüneteinek viszonylag rövid idő alatt történő kifejlődésének előnye, de olyan hibáktól szenvednek, amelyek többségében a tükröződés a makula hiány. Kritikus szempontból egyetlen modell sem volt sikeres az AMD-betegségek teljes spektrumának reprodukálásában, bár vannak olyan kényszerítő modellek, amelyek a betegség mind földrajzi, mind exudatív formájának korlátozott jellemzőit reprodukálják. Ezzel szemben a nem főemlősök használata lehetőséget kínál az AMD tanulmányozására egy olyan rendszerben, amely jobban hasonlít az emberre és fiziológiájára, de számos hátránya van, köztük jelentős etikai vonatkozások, genetikai manipulációs problémák és hosszabb időskálák. a betegség kezdetéig.
Β és AMD - a neurodegeneráció tanulságai és további lépések
Itt megvitattuk azt a hipotézist és izgalmas új eredményeket, amelyek azt mutatják, hogy az Aβ képes kulcsszerepet játszani az AMD-ben, amelynek tanulmányozása jobban megértheti a korai betegség mechanizmusait, valamint a krónikus retinát fenntartó molekuláris útvonalakat degeneráció. Az AD-ben szenvedő betegek megosztott patológiájára példaként említhető az idegrostrétegek vastagságának csökkenése, a retina kóros vérkeringésének 99-es eltérése, 62 valamint a koroidok vastagságának csökkentése, 100 olyan hely, ahol degeneráció is előfordul glaukómában és AMD-ben. 1, 5, 74 Hasonló jellemzők találhatók az AD szenilis plakkjai és az AMD drusen6 között, valamint a szelektív szövetkárosodás mintázata, ami megosztott molekuláris mechanizmusokra utal, legalábbis e betegségek egyes szakaszaiban. Az Aβ és a kapcsolódó retina patológiájának vizsgálata új perspektívákat kínálhat az AMD-vel kapcsolatban, és új szempontból közelítheti meg ezt a gyengítő vakító betegséget. Ilyen vizsgálatok laboratóriumunkban már folyamatban vannak.